L’alfa-amilasi (EC 3.2.1.1) è un enzima che catalizza l’idrolisi di legami glicosidici α-(1→4) presenti all’interno di catene lineari di amilosio e amilopectina, i due principali costituenti dei granuli di amido.[2]
L’enzima è ampiamente diffuso negli animali, piante, funghi, nei phyla Ascomiceti e Basidiomiceti, batteri, nel genere Bacillus, e negli Archea. La sua ampia distribuzione suggerisce un suo ruolo centrale nel metabolismo dei carboidrati.[15]
Nell’uomo l’alfa-amilasi è codificata da due geni differenti, ed è prodotta principalmente delle ghiandole parotidi e dal pancreas esocrino.[9] Nelle piante sei differenti geni codificano per altrettante isoforme dell’enzima.[11]
Negli animali è coinvolta nel primo passaggio della digestione dell’amido, con liberazione del disaccaride maltosio, degli oligosaccaridi maltotriosio e destrine alfa-limite, e di piccole quantità di glucosio.[5]
Poiché l’amido è la principale fonte di alimentare di carboidrati, e quindi di glucosio ed energia, l’attività catalitica dell’alfa-amilasi può influenzare la regolazione della glicemia postprandiale.[8]
L’alfa-amilasi è utilizzata in diversi settori industriali, nonché nella diagnostica clinica.[7]
Nelle piante, e in particolare nelle graminacee quali grano, orzo e riso, è cruciale per la germinazione dei semi e la maturazione dei chicchi.[11][17]
Indice
- Storia
- Geni dell’alfa-amilasi umana
- Azione catalitica
- Alfa-amilasi salivare
- Alfa-amilasi pancreatica
- Controllo della glicemia
- Dosaggio dell’amilasi sierica
- Alfa-amilasi del grano
- Bibliografia
Storia
La prima rilevazione di un’attività amilasica risale al 1811, a opera del chimico russo Konstantin Sigizmundovič Kirchhoff, che, lavorando con il grano, scoprì la prima attività enzimatica capace di degradare l’amido del cereale.[16]
A questo lavoro seguirono, nel 1831, gli studi Erhard Friedrich Leuchs che osservò la degradazione dell’amido quando veniva miscelato con la saliva umana. Leuchs chiamò ptialina l’agente responsabile di questa reazione chimica.
Nel 1833, Anselme Payen e Jean-François Persoz, chimici francesi che lavoravano in uno zuccherificio, isolarono dall’orzo un enzima in grado di degradare l’amido, enzima che fu chiamato distasi.[5]
Il nome di alfa-amilasi si deve a Richard Kuhn, che nel 1925 scoprì che i prodotti dell’idrolisi catalizzata dall’enzima erano in configurazione alfa.[13]
L’alfa-amilasi fu anche il primo enzima a essere prodotto industrialmente, nel 1894, estratto da un fungo e utilizzato per il trattamento di disordini digestivi. In seguito, a partire dal 1917, venne estratto anche da Bacillus subtilis e Bacillus mesentericus. Attualmente la maggior parte viene prodotta da organismi geneticamente modificati.[15]
L’alfa-amilasi, e più in generale le amilasi, di cui ne esistono almeno altri due tipi, la beta-amilasi (EC 3.2.1.2) e la gamma-amilasi (EC 3.2.1.3), trovano largo impiego in settori industriali differenti, come quello alimentare, dei mangimi, il settore tessile, la produzione delle birra e del whisky, l’industria farmaceutica, cosmetica e la diagnostica clinica.[7]
Le alfa-amilasi possono essere classificate, sulla base del grado d’idrolisi del substrato, come liquefanti, se idrolizzano il 30-40% dei legami glicosidici dell’amido, e saccarificanti, se l’idrolisi arriva al 50-60%.[15]
Geni dell’alfa-amilasi umana
In molti mammiferi, compreso l’uomo, l’alfa-amilasi è codificata da due geni distinti ma strettamente correlati, presenti sul braccio corto del cromosoma 1, e indicati come:
- AMY1, che codifica per l’isoforma presente nella saliva, nella ghiandola mammaria, e in alcuni tipi di tumore, come quello del polmone;[5]
- AMY2, che codifica per l’enzima prodotto dal pancreas. AMY2 è presente in due forme, AMY2A e AMY2B, il cui numero di copie per gene differisce nelle diverse popolazioni, sebbene due copie per gene sembra essere un pattern frequente. Sembra anche che il numero di copie di AMY2 sia associato a quello di AMY1.[9]
Azione catalitica
L’alfa-amilasi catalizza il primo passaggio nella digestione dell’amido, vale a dire l’idrolisi dei legami glicosidici α-(1→4) presenti all’interno delle catene lineari di amilosio e amilopectina, agendo su posizioni casuali lungo gli α-glucani. L’enzima è quindi una endoglicosidasi, ha un pH ottimale di circa 7, richiede la presenza di ioni calcio, e porta al rilascio di disaccaridi e oligosaccaridi in configurazione alfa, nello specifico, maltosio e maltotriosio dall’amilosio, e maltosio, destrine alfa-limite e glucosio, quest’ultimo in minima quantità, dall’amilopectina.[2]
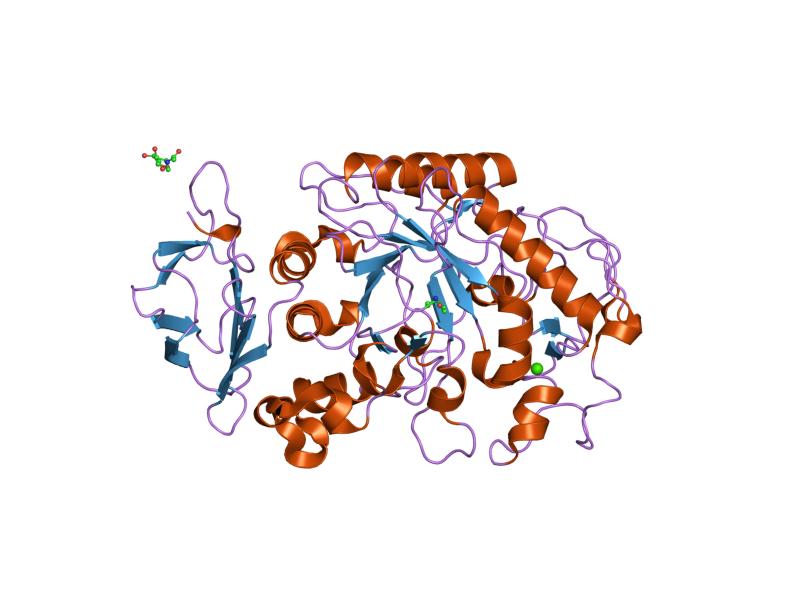
L’alfa-amilasi, al pari di altri enzimi coinvolti nel metabolismo dell’amido, come la pullulanasi (EC 3.2.1.41), la isoamilasi (EC 3.2.1.68), gli enzimi ramificanti l’amido (EC 2.4.1.18) e gli enzimi deramificanti l’amido, appartiene alla famiglia delle glicosil idrolasi 13 o GH-13, enzimi in grado di agire su substrati contenenti legami α-glicosidici.[10]
A questa famiglia appartengono anche due enzimi coinvolti nel metabolismo del trealosio, la trealosio sintasi (EC 5.4.99.16), che catalizza l’interconversione tra maltosio e trealosio, e la trealosio-6-fosfato idrolasi (EC 3.2.1.93), che idrolizza il trealosio a dare una molecola di glucosio e una di glucosio-6-fosfato.
Alfa-amilasi salivare
L’alfa-amilasi salivare o ptialina è sintetizzata principalmente dalle ghiandole parotidi, e in misura minore dalle ghiandole sottomandibolari.
Presente in due forme, una glicosilata e una non glicosilata, è coinvolta nella prima, limitata, digestione dell’amido che avviene nella cavità orale.
L’enzima è una delle proteine salivari più abbondanti, rappresentando il 40-50% di tutte quelle presenti, e, con la lipasi linguale (EC 3.1.1.3), coinvolta nella digestione dei lipidi, quali i trigliceridi e gli esteri del colesterolo, è uno dei più importanti enzimi salivari.[3]
Alfa-amilasi pancreatica
L’alfa-amilasi pancreatica è prodotta dalle cellule acinose del pancreas.
E’ una delle principali proteine del succo pancreatico, e con esso viene secreta nel duodeno dove attacca amilosio e amilopectina, portando a termine la prima parte dell’amilolisi. I prodotti dell’idrolisi sono quindi attaccati dalle alfa-glucosidasi dell’orletto a spazzola degli enterociti, ossia la saccarasi-isomaltasi (EC 3.2.1.48) e la maltasi-glucoamilasi (EC 3.2.1.20), enzimi che idrolizzano anche il legame glicosidico α-(1→2) del saccarosio.[14]
L’alfa-amilasi pancreatica dei mammiferi è in grado di legarsi a N-glicani di glicoproteine dell’orletto a spazzola.[1] Questo legame consente la cooperazione con la saccarasi-isomaltasi, il che determina un notevole aumento del rilascio di glucosio. Tuttavia è stato osservato che l’uptake del glucosio da parte di SGLT1, uno dei trasportatori intestinali coinvolti nell’assorbimento dei monosaccaridi, è inibito da elevate concentrazioni intestinali di alfa-amilasi. E’ stato ipotizzato che questo processo possa rappresentare un meccanismo di regolazione innata per evitare improvvisi aumenti dell’assorbimento del glucosio, e quindi facilitare la regolazione della glicemia postprandiale.[6]
Controllo della glicemia
Il controllo della glicemia postprandiale è ritenuto una valida strategia nella prevenzione dello sviluppo del diabete di tipo II. Tra le metodiche non farmacologiche che è possibile adottare c’è la riduzione della capacità dell’alfa-amilasi di attaccare l’amido attraverso una lavorazione degli alimenti che porti alla retrogradazione dell’amido stesso, o a mezzo di molecole presenti nei cibi che, con diverse modalità d’azione, ne riducano l’attività.[8]
Lavorazione dei cibi
I processi idrotermici cui i cibi ricchi di amido sono sottoposti, ad esempio la cottura in acqua bollente, fanno si che i granuli di amido vadano incontro al fenomeno della gelatinizzazione, ossia assorbano acqua, si rigonfino e perdano buona parte delle loro strutture cristalline, sostituite da strutture amorfe, più facilmente attaccabili dalle alfa-amilasi.[4] Se l’amido gelatinizzato viene fatto raffreddare si può verificare una ricristallizzazione che porta alla formazione di quello che è conosciuto come amido retrogradato, un tipo di amido resistente all’azione dell’alfa-amilasi e che è in grado di raggiungere praticamente intatto il colon, dove viene fermentato dai batteri del microbiota intestinale, al pari della fibra solubile.
Ruolo dei polifenoli
La digestione dell’amido da parte dell’alfa-amilasi è influenzata da molecole presenti negli alimenti, quali i polisaccaridi non amidacei della parete cellulare, proteine, lipidi, e, tra i fitochimici, diversi tipi di polifenoli.[4] Questi composti possono limitare l’azione dell’enzima in almeno quattro modi differenti.[8]
- Le proteine e i polisaccaridi non amidacei sono in grado di limitare la perdita della struttura ordinata dell’amido nativo nel corso dei processi idrotermici cui è sottoposto il cibo durante la lavorazione.
- I lipidi, i polifenoli, le proteine e i polisaccaridi non amidacei possono formare strutture ordinate con l’amido.
- Le proteine, i polisaccaridi non amidacei e i polifenoli possono formare barriere fisiche che riducono l’accesso degli enzimi idrolitici alle catene degli alfa-glucani.
- I polifenoli e i polisaccaridi non amidacei sono in grado di ridurre l’attività dell’alfa-amilasi e delle alfa-glucosidasi.
Tra i polifenoli sembrano essere importanti alcuni tipi di flavonoidi come le proantocianidine o tannini condensati.[8] Per essere efficace, l’assunzione di alimenti ricchi di polifenoli, come il tè nero o il te verde, deve essere associata al pasto ricco in carboidrati. Il glutine sembra in grado di ostacolare l’interazione tra polifenoli e granuli di amido, e dunque ridurne l’effetto inibitorio.
Dosaggio dell’amilasi sierica
Il dosaggio dell’attività sierica dell’alfa-amilasi viene utilizzato come test diagnostico di laboratorio.[7]
L’aumento dei livelli sierici dell’attività dell’enzima può derivare da:
- una pancreatite acuta o una riacutizzazione di una pancreatite cronica;
- un’infiammazione a carico delle ghiandole parotidi;
- un’ostruzione dei dotti secretori delle ghiandole parotidi o del dotto pancreatico.
I test attualmente in uso non distinguono tra le isoforme salivare e pancreatica. Tuttavia, se l’aumento dell’attività amilasica è associato a quello dell’attività lipasica, la patologia sottostante è probabilmente di origine pancreatica.
Alfa-amilasi del grano
Nelle piante, e in particolare nel grano, l’alfa-amilasi ha un ruolo nella germinazione e nel processo di maltazione, ossia una germinazione controllata che porta alla conversione del grano in malto che viene utilizzato principalmente per la produzione di whisky e birra.[11]
Nei chicchi di grano l’enzima viene sintetizzato principalmente nelle prime fasi della germinazione, che sono eterotrofiche in quanto dipendono fortemente dalle risorse immagazzinate, e quindi anche sull’amido presente nell’endosperma.[17] La sintesi dell’enzima avviene nello strato aleuronico, e da inizio alla mobilizzazione delle riserve di amido.
L’alfa-amilasi è coinvolta anche in uno dei principali difetti del grano, la germinazione pre-raccolta.
Bibliografia
- ^ Asanuma-Date K., Hirano Y., Le N., Sano K., Kawasaki N., Hashii N., Hiruta Y., Nakayama K., Umemura M., Ishikawa K., Sakagami H., and Ogawa H. Functional regulation of sugar assimilation by N-glycan-specific interaction of pancreatic α-amylase with glycoproteins of duodenal brush border membrane. J Biol Chem 2012;287(27):23104-18. doi:10.1074/jbc.m111.314658
- ^ a b Benjamin S., Smitha R.B., Jisha V.N., Pradeep S., Sajith S., Sreedevi S., Priji P., Unni K.N., Sarath Josh M.K. A monograph on amylases from Bacillus spp. Adv biosci biotechnol 2013;4:No.2. doi:10.4236/abb.2013.42032
- ^ Boehlke C., Zierau O., Hannig C. Salivary amylase – The enzyme of unspecialized euryphagous animals. Arch Oral Biol 2015;60(8):1162-76. doi:10.1016/j.archoralbio.2015.05.008
- ^ a b Butterworth P.J., Bajka B.H., Edwards C.H., Warren F.J., Ellis P.R. Enzyme kinetic approach for mechanistic insight and predictions of in vivo starch digestibility and the glycaemic index of foods. Trends Food Sci Technol 2022;120:254-264. doi:10.1016/j.tifs.2021.11.015
- ^ a b c Butterworth P.J., Warren F.J. and Ellis P.R. Human α-amylase and starch digestion: an interesting marriage. Starch/Stärke 2011;63:395-405. doi:10.1002/star.201000150
- ^ Date K., Satoh A., Lida K., Ogawa H. Pancreatic α-amylase controls glucose assimilation by duodenal retrieval through N-glycan-specific binding, endocytosis, and degradation. J Biol Chem 2015;290(28):17439-50. doi:10.1074/jbc.M114.594937
- a b c de Souza P.M., de Oliveira Magalhães P. Application of microbial α-amylase in industry – A review. Braz J Microbiol 2010;41(4):850-61. doi:10.1590/S1517-83822010000400004
- ^ a b c d Gong L., Feng D., Wang T., Ren Y., Liu Y., Wang J. Inhibitors of α-amylase and α-glucosidase: potential linkage for whole cereal foods on prevention of hyperglycemia. Food Sci Nutr 2020;8(12):6320-6337. doi:10.1002/fsn3.1987
- ^ a b Iafrate A.J., Feuk L., Rivera M.N., Listewnik M.L., Donahoe P.K., Qi Y., Scherer S.W, Lee C. Detection of large-scale variation in the human genome. Nature Genetics. 2004;36:949–951. doi:10.1038/ng1416
- ^ Janeček Š., Svensson B., MacGregor E.A. α-Amylase: an enzyme specificity found in various families of glycoside hydrolases. Cell Mol Life Sci 2014;71(7):1149-70. doi:10.1007/s00018-013-1388-z
- ^ a b c Ju L., Pan Z., Zhang H., Li Q., Liang J., Deng G., Yu M., Long H. New insights into the origin and evolution of α-amylase genes in green plants. Sci Rep 2019;9(1):4929. doi:10.1038/s41598-019-41420-w
- ^ Keller P.J., Allan B.J. The protein composition of human pancreatic juice. J Biol Chem 196725;242(2):281-7. doi:10.1016/S0021-9258(19)81461-8
- ^ Kuhn R. Mechanism of the action of amylases. Constitution of starch. Justus Liebigs Annalen der Chemie 1925;443:1-71
- ^ Nichols B.L., Avery S., Sen P., Swallow D.M., Hahn D., Sterchi E. The maltase-glucoamylase gene: common ancestry to sucrase-isomaltase with complementary starch digestion activities. Proc Natl Acad Sci U S A. 2003 Feb 4;100(3):1432-7. doi:10.1073/pnas.0237170100
- ^ a b c Tiwari S.P., Srivastava R., Singh C.S., Shukla K., Singh R.K., Singh P., Singh R., Singh N.L., and Sharma R. Amylases: an overview with special reference to alpha amylase. Journal of Global Biosciences 2015;4(SI1):1886-1901.
- ^ Zakowski J.J., Bruns D.E. Biochemistry of human alpha amylase isoenzymes. Crit Rev Clin Lab Sci 1985;21(4):283-322. doi:10.3109/10408368509165786
- ^ a b Zhang Q., Pritchard J., Mieog J., Byrne K., Colgrave M.L., Wang J.R., Ral J.F. Over-expression of a wheat late maturity alpha-amylase type 1 impact on starch properties during grain development and germination. Front Plant Sci 2022;13:811728. doi:10.3389/fpls.2022.811728