Gli acidi e i sali biliari sono derivati polari del colesterolo, e rappresentano la principale via per l’eliminazione dello steroide dal corpo.
Sono un gruppo di specie molecolari con struttura chimica simile ma non identica, proprietà fisiche differenti e caratteristiche biologiche anche più divergenti.
Sono sintetizzati nel fegato, immagazzinati nella cistifellea, secreti nel duodeno, e infine per la maggior parte riassorbiti nell’ileo.
Poiché a pH fisiologico sono presenti in forma di anioni, i termini acido biliare e sale biliare saranno di seguito utilizzati come sinonimi.
Indice
- Struttura chimica
- Acidi e sali biliari primari, coniugati e secondari
- Funzione dei sali biliari
- Circolo enteroepatico
- Sintesi
- Bibliografia
Struttura chimica
I sali biliari presentano analogia e differenze con la molecola del colesterolo.
Al pari dello steroide posseggono un nucleo formato da 4 anelli fusi, tre a sei atomi di carbonio, indicati come A, B e C, e uno, indicato come D, a 5; tale struttura è il ciclopentanoperidrofenantrene, più comunemente noto come nucleo steroideo.
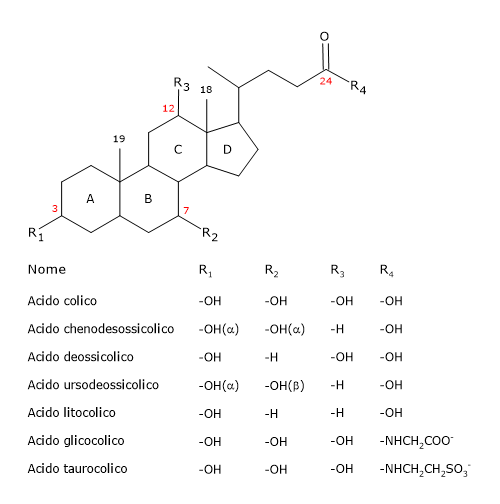
Negli vertebrati superiori sono formati da 24 atomi di carbonio, poiché hanno una coda idrocarburica più corta di tre atomi di carbonio rispetto a quella del colesterolo. Nei vertebrati inferiori sono formati a 25, 26 o 27 atomi di carbonio. La coda idrocarburica termina con un gruppo carbossilico, spesso ionizzato a pH 7, che può essere legato all’aminoacido glicina o taurina.
Oltre al gruppo ossidrilico in posizione 3, possono avere gruppi ossidrilici in posizione 7 e/o 12.
Tutto ciò rende queste molecole molto più polari del colesterolo.
Poiché gli anelli A e B sono fusi in configurazione cis, la struttura del nucleo steroideo risulta curva, ed è possibile individuarvi:
- un lato concavo, verso cui sono orientati i gruppi idrossilici e il gruppo carbossilico della catena laterale, con o senza l’aminoacido a esso legato, e che risulta idrofilico;
- un lato convesso, verso cui sono orientati i gruppi metilici presenti in posizione 18 e 19, che risulta idrofobico.
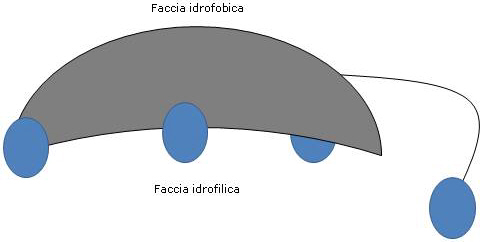
Dunque, possedendo sia gruppi polari che non polari sono molecole anfifiliche e ottimi surfattanti. Tuttavia la loro struttura chimica li rende molto diversi rispetto ai surfattanti tradizionali, dove spesso si individua una testa polare e una lunga coda non polare.
Acidi e sali biliari primari, coniugati e secondari
Sono definiti acidi biliari primari le molecole sintetizzate negli epatociti direttamente dal colesterolo. Nell’uomo i principali sono l’acido colico e l’acido chenodesossicolico, che da soli formano fino all’80% di tutti gli acidi biliari.
Prima di essere secreti nell’albero biliare sono coniugati quasi per intero, sino al 98%, con gli amminoacidi glicina o taurina, a dare rispettivamente glicoconiugati e tauroconiugati. In particolare circa il 75% dell’acido colico e chenodesossicolico sono coniugati con la glicina, a dare acido glicocolico e acido glicochenodesossicolico, il restante 25% con la taurina, a dare acido taurocolico e acido taurochenodesossicolico.
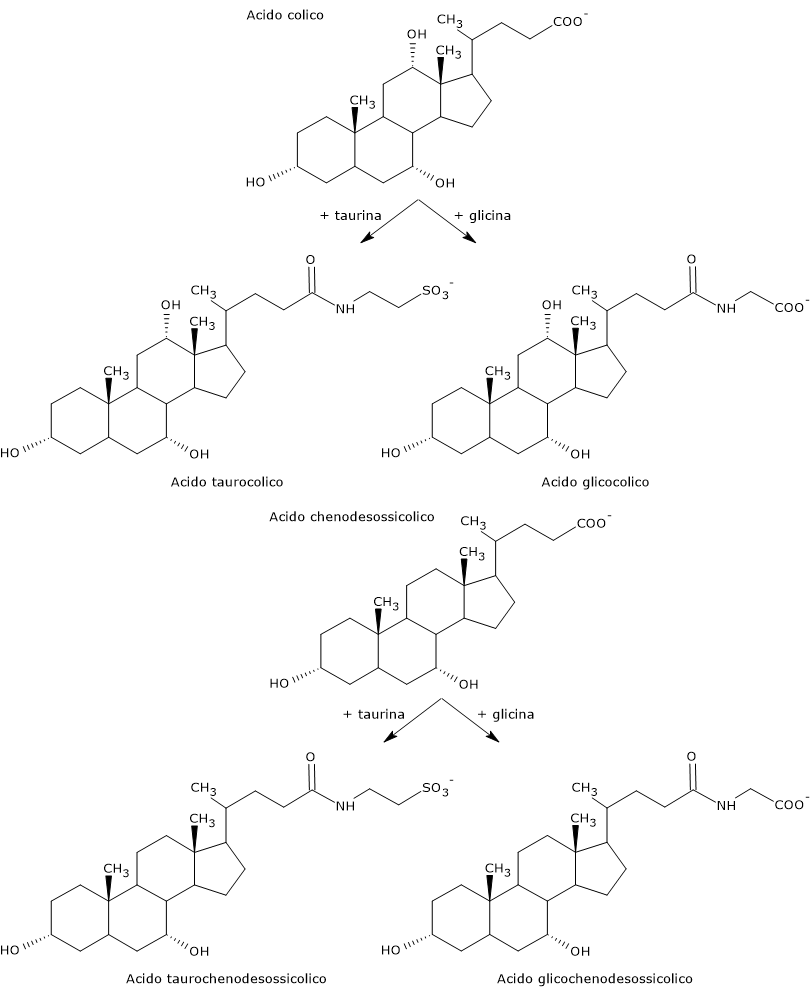
Gli acidi biliari coniugati sono molecole dotate di gruppi maggiormente idrofilici rispetto a quelle di origine, dunque sono emulsionanti molto più efficaci. La coniugazione ha infatti l’effetto di ridurre il loro pKa facendo si che rimangano ionizzate in un intervallo più ampio di pH. Se infatti il pKa tipico dei non coniugati è di circa 6, si passa a circa 4 con l’acido glicocolico, e circa 2 con l’acido taurocolico.
L’idrofilicità dei comuni acidi e sali biliari decresce secondo il seguente ordine: coniugati della glicina < coniugati della taurina < acido litocolico < acido desossicolico < acido chenodesossicolico < acido colico < acido ursodesossicolico.
Infine la coniugazione ha anche l’effetto di ridurre la citotossicità delle molecole di origine.
Gli acidi biliari secondari derivano dai primari che non sono stati riassorbiti durante il loro passaggio nell’intestino tenue. Una volta raggiunto il colon, gli acidi biliari primari possono infatti subire diverse modificazioni ad opera del microbiota intestinale, che è parte del più ampio microbiota umano, a dare appunto gli acidi biliari secondari. Con gli acidi grassi a catena corta sono sono i due principali tipi di metaboliti batterici prodotto nel colon, e formano il il restante 20% del pool corporeo totale degli acidi biliari.
Un altro modo di suddividere i sali biliari fa riferimento alla loro coniugazione con aminoacidi e al grado di idrossilazione. Su queste base si individuano tre categorie.
- I coniugati triidrossilati, quali l’acido taurocolico e il glicocolico.
- I coniugati diidrossilati, come l’acido glicodesossicolico, glicochenodesossicolico, taurochenodesossicolico e taurodesossicolico. Nella bile rappresentano circa il 60% del totale dei sali biliari.
- Forme non coniugate come l’acido colico, desossicolico, chenodesossicolico, e litocolico.
Funzione dei sali biliari
Premessa: tutte le funzioni fisiologiche sono portate a termine dai sali biliari in forma coniugata.
- Rappresentano la via principale per l’eliminazione del colesterolo. Nell’uomo infatti non esiste il corredo enzimatico necessario per rompere nessuno dei quattro anelli del nucleo steroideo, ne per ossidare il colesterolo ad anidride carbonica e acqua.
L’altro modo per eliminare il colesterolo è con la bile, in forma libera. - I sali biliari sono potenti surfattanti. E in particolare, i coniugati di- e triidrossilati sono i surfattanti migliori, molto più efficaci rispetto ai corrispettivi non coniugati, avendo un numero maggiore di gruppi polari.
Una volta a contatto con i lipidi apolari nel lume del piccolo intestino, il lato convesso apolare va a interagire con i lipidi idrofobici, quali trigliceridi, esteri del colesterolo e delle vitamine liposolubili, mentre il lato concavo polare prende contatto con il mezzo acquoso circostante. Ciò incrementa la dispersione nel mezzo acquoso dei lipidi apolari, favorendo la formazione di minuscole goccioline lipidiche, che subiranno l’attacco delle lipasi, in particolare della lipasi pancreatica, nella cui attivazione i sali biliari hanno un ruolo diretto, e delle esterasi intestinali. In seguito facilitano l’assorbimento dei lipidi prodotti, nonché delle vitamine liposolubili, ad opera della mucosa intestinale grazie alla formazione di micelle miste.
Una funzione simile è svolta nella cistifellea dove, formando micelle miste con i fosfolipidi, prevengono la precipitazione del colesterolo.
Nota: grazie alla disposizione dei gruppi polari e non polari, una volta in soluzione acquosa, i sali biliari tendono a formare micelle, di solito composte da meno di 10 monomeri, purché la loro concentrazione sia superiore alla cosiddetta concentrazione micellare critica.
- A livello intestinale modulano la secrezione degli enzimi pancreatici e della colecistochinina.
- Sia nell’intestino tenue che nel colon hanno una potente attività antimicrobica, in primis l’acido desossicolico, in particolare contro i batteri Gram-positivi. Questa attività potrebbe essere dovuta a danno ossidativo al DNA e/o al danno alle membrane cellulari batteriche. Sono dunque importanti nella prevenzione della sovracrescita batterica, ma sembra abbiano anche un ruolo nella regolazione della composizione del microbiota intestinale.
- Negli ultimi anni è divenuto evidente il loro ruolo regolatorio sul controllo del metabolismo energetico, in particolare per la “movimentazione” epatica del glucosio.
Circolo enteroepatico
A seguito del consumo di lipidi con la dieta, le cellule enteroendocrine del duodeno secernono in circolo la colecistochinina. Il successivo legame dell’ormone alle cellule muscolari lisce della parete della cistifellea ne promuove la contrazione; inoltre l’ormone causa anche il rilascio dello sfintere di Oddi. Da tutto ciò risulta la secrezione pulsatile della bile, e degli acidi biliari in essa contenuti, nel duodeno.
In condizioni fisiologiche il pool corporeo di acidi biliari è costante, e pari a circa 3-5 g; ciò è reso possibile da due processi:
- il loro riassorbimento a livello intestinale;
- la loro sintesi de novo.
Fino al 95% dei sali biliari secreti viene riassorbito a livello intestinale, non assieme ai prodotti della digestione dei lipidi, ma attraverso un processo definito circolo enteroepatico.
Si tratta di un sistema di recupero estremamente efficiente, che sembra avvenire almeno due volte per ogni pasto, cui partecipano il fegato, l’albero biliare, il duodeno, il colon, e il circolo portale attraverso cui le molecole riassorbite tornano al fegato. Tale ricircolo è reso necessario dal fatto che la capacità dell’epatocita di produrre acidi biliari è limitata e insufficiente a soddisfare le necessità fisiologiche intestinali se gli stessi sali andassero perduti in elevate quantità.
La maggior parte dei sali biliari è riassorbita una volta raggiunto l’ileo distale, la parte più bassa dell’intestino tenue, a mezzo di un trasportatore sodio-dipendente presente nell’orletto a spazzola degli enterociti, detto ASBT, acronimo dell’inglese apical sodium-dependent bile acid transporter, che opera un cotrasporto di due ioni sodio e un acido biliare.
Una volta nell’enterocita si ritiene che, a mezzo della proteina IBABP, acronimo dell’inglese ileal bile acid-binding protein, siano trasportati attraverso il citosol alla membrana basolaterale, che attraversano grazie all’intervento del trasportatore OSTalfa/OSTbeta, acronimo dell’inglese organic solute transporter alpha and beta. Tramite il circolo portale, veicolati dall’albumina, raggiungono il fegato.
Da notare che una piccola parte di acidi biliari raggiunge il fegato attraverso l’arteria epatica.
A livello epatico la loro estrazione dal circolo è molto efficiente, tanto che dal 50 al 90% sono rimossi al primo passaggio, percentuale che varia in funzione della struttura molecolare. Gli acidi biliari coniugati sono in gran parte rimossi attraverso un meccanismo di trasporto attivo sodio-dipendente, a mezzo del trasportatore NTCP, acronimo dell’inglese Na+-dependent taurocholate co-transport polipeptide. Tuttavia può avvenire anche un trasporto sodio-indipendente ad opera di proteine della famiglia OATP, acronimo dell’inglese organic anion transporting polypeptides, principalmente le isoforme OATP1B1 e OATP1B3.
Nel circolo enteroepatico il passaggio limitante è rappresentato dalla loro secrezione nei canalicoli biliari, in gran parte ad opera di BSEP, acronimo dell’inglese bile salt export pump, in un processo ATP-dipendente. Questa pompa trasporta gli acidi biliari monoanionici, che sono la maggior parte. Gli acidi biliari solforati o glucuronati, dianionici, sono secreti a mezzo di trasportatori differenti, quali MRP2 e BCRP.
Nota: il livello sierico degli acidi biliari varia sulla base della velocità di riassorbimento e quindi è più alto durante i pasti, quando il circolo enteroepatico è più attivo.
Metabolismo intestinale
Gli acidi biliari che sfuggono al riassorbimento ileale passano nel colon dove in parte subiscono l’azione di enzimi della flora batterica e sono trasformati in acidi biliari secondari.
Di seguito sono elencate le principali reazioni.
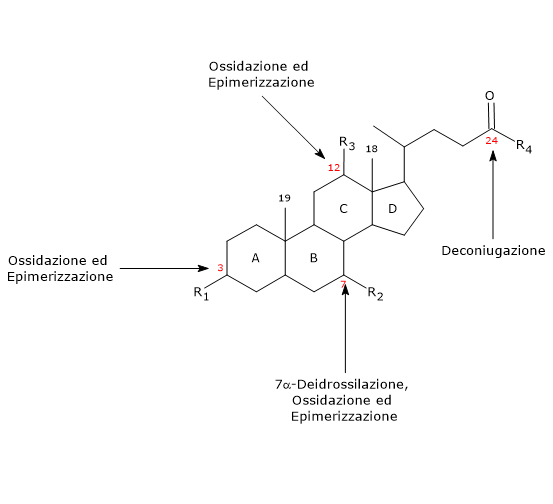
- Deconiugazione
A livello della catena laterale si può verificare l’idrolisi del legame con l’aminoacido coniugato in posizione 24, con liberazione di acidi biliari non coniugati e glicina o taurina. Le reazioni sono catalizzate da idrolasi batteriche presenti sia nell’intestino tenue che nel colon. - 7alfa-Deidrossilazione
E’ la reazione quantitativamente più importante, portata a termine da deidratasi batteriche coloniche che rimuovono il gruppo ossidrilico in posizione 7 dando origine ad un 7-deossi acido biliare. In particolare, dall’acido colico si formerà l’acido desossicolico, mentre dal chenodesossicolico il litocolico, due acidi biliari secondari tossici.
Da notare che la 7alfa-deidrossilazione, a differenza di quanto accade con l’ossidazione e l’epimerizzazione, può avvenire solamente sugli acidi biliari non coniugati, per cui la deconiugazione è un prerequisito essenziale. - Ossidazione ed epimerizzazione
Sono reazioni che interessano i gruppi idrossilici in posizione 3, 7 e 12, catalizzate da idrossisterolo deidrogenasi batteriche. Ad esempio, l’epimerizzazione dell’acido chenodesossicolico da origine all’acido ursodesossicolico.
Parte degli acidi biliari secondari sono poi riassorbiti e tornano al fegato, per essere riconiugati, se necessario, e secreti nuovamente. Quelli che invece sfuggono al riassorbimento saranno perduti con le feci.
Mentre le reazioni di deconiugazione e ossidazione sono portate a termine da un ampio spettro di batteri anaerobi, le 7alfa-deidrossilazioni sono effettuate da un numero ristretto di anaerobi.
La 7alfa-deidrossilazione e la deconiugazione hanno come effetto quello di aumentare il pKa e dunque l’idrofobicità degli acidi biliari, permettendone un certo grado di recupero passivo attraverso l’epitelio colonico.
L’aumento di idrofobicità è associato anche ad un aumento della loro citotossicità. E una elevata concentrazione di acidi biliari secondari nelle feci, sangue e bile è stata associata alla patogenesi del cancro al colon.
Riassorbimento e fibre solubili
Il riassorbimento degli sali biliari può essere ridotto dall’azione chelante delle fibre solubili, come quelle presenti nella frutta fresca, legumi, avena e crusca d’avena. Tutto questo ha come effetto quello di incrementare la loro sintesi de novo, up-regolando l’espressione della colesterolo 7alfa-idrossilasi e della sterolo 12alfa-idrossilasi, e quindi ridurre la concentrazione del colesterolo negli epatociti.
La deplezione del colesterolo epatico aumenta l’espressione del recettore per le LDL, e quindi abbassa la concentrazione plasmatica del colesterolo LDL. Di contro però stimola anche la sintesi della HMG-CoA reduttasi, l’enzima chiave nella sintesi dello steroide.
Anche diversi farmaci agiscono legando gli acidi biliari a livello intestinale, impedendone così il riassorbimento.
Sintesi
Dal punto di vista quantitativo, gli acidi biliari sono il prodotto principale del metabolismo del colesterolo.
Come detto in precedenza, il circolo enteroepatico e la loro sintesi de novo assicurano la costanza del pool corporeo. In particolare, la sintesi de novo permette la sostituzione di quel 5-10%, circa 0,5 g/die, che viene perduto con le feci.
Di seguito verrà presa in esame la sintesi dell’acido colico e dell’acido chenodesossicolico, e la loro coniugazione con gli aminoacidi taurina e glicina.
Esistono due vie principali per la sintesi dei suddetti acidi: la via classica e quella alternativa. A queste si aggiungono alcune vie minori.
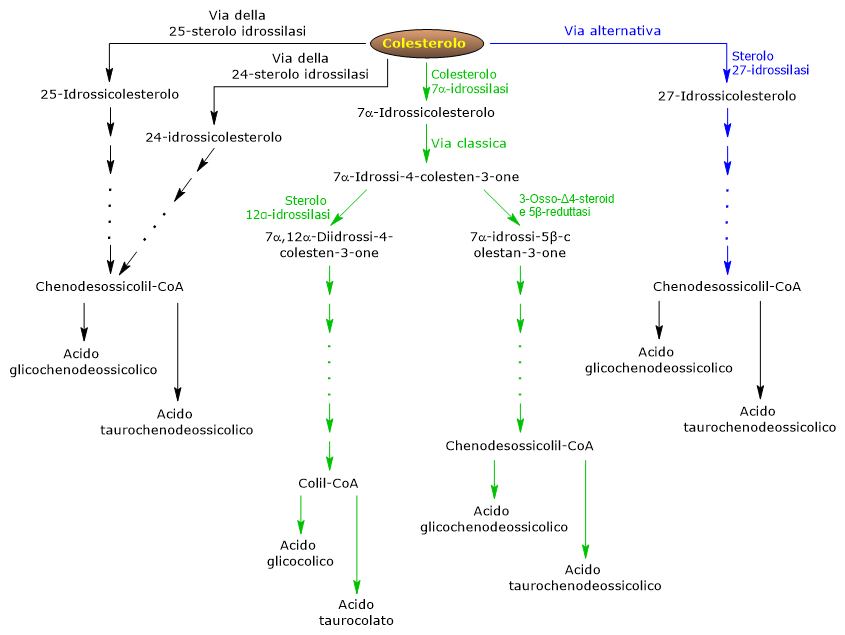
La via classica o neutra
Nell’uomo fino al 90% dei sali biliari sono sintetizzati attraverso la via classica, definita anche “neutra” in quanto i suoi intermedi sono steroli neutri.
E’ una via presente solo nel fegato, cui prendono parte numerosi enzimi localizzati nel citosol, nel reticolo endoplasmatico, nei mitocondriale e perossisomi, e i cui prodotti finali sono i coniugati degli acidi colico e chenodesossicolico.
- La prima reazione è l’idrossilazione in posizione 7 del colesterolo, a dare il 7alfa-idrossicolesterolo. La reazione è catalizzata dalla colesterolo 7alfa-idrossilasi o CYP7A1 (E.C. 1.14.14.23). E’ un enzima localizzato sul reticolo endoplasmatico, e catalizza il passaggio limitante dell’intera via.
Colesterolo + NADPH + H+ + O2 → 7alfa-Idrossicolesterolo + NADP+ + H2O
- Il 7alfa-idrossicolesterolo subisce l’ossidazione del gruppo 3beta-ossidrilico e lo spostamento del doppio legame dalla posizione 5,6 alla posizione 4,5 a dare il 7alfa-idrossi-4-colesten-3-one. La reazione è catalizzata dalla 3beta-idrossi-Δ5-C27-steroide ossidoreduttasi o HSD3B7 (E.C. 1.1.1.181), un enzima del reticolo endoplasmatico.
- Il 7alfa-idrossi-4-colesten-3-one può seguire due vie:
entrare nella via che porta alla sintesi dell’acido colico, attraverso la reazione catalizzata dalla 7alfa-idrossi-4-colesten-3-one 12alfa-monoossigenasi o sterolo 12alfa-idrossilasi o CYP8B1 (E.C. 1.14.18.8), enzima del reticolo endoplasmatico;
entrare nella via che porta la sintesi dell’acido chenodesossicolico, attraverso la reazione catalizzata dalla 3-osso-Δ4-steroide 5β-reduttasi o AKR1D1 (E.C. 1.3.1.3), enzima citosolico.
Ed è l’attività della sterolo 12alfa-idrossilasi che determinerà il rapporto tra gli acidi colico e chenodesossicolico prodotti, e, in definitiva, quella che sarà la potenza detergente del pool degli acidi biliari. E infatti la regolazione della trascrizione del gene corrispondente è uno dei punti di regolazione principali dell’intera via di sintesi.
Dunque, se il 7alfa-idrossi-4-colesten-3-one fluisce attraverso la reazione catalizzata dalla sterolo 12alfa-idrossilasi si avranno le seguenti reazioni.
- La molecola è idrossilata in posizione 12 dall’enzima suddetto, a dare il 7alfa,12alfa-diidrossi-4-colesten-3-one.
- Il 7alfa,12alfa-diidrossi-4-colesten-3-one subirà la riduzione del doppio legame in posizione 4,5, nella reazione catalizzata dalla 3-osso-Δ4-steroide 5beta-reduttasi, a dare 5beta-colestan-7alfa,12alfa-diol-3-one.
- Il 5beta-colestan-7alfa,12alfa-diol-3-one subirà a sua volta la riduzione a gruppo ossidrilico del gruppo in posizione 4, nella reazione catalizzata dalla 3alfa-idrossisteroide deidrogenasi o AKR1C4 (EC 1.1.1.213), enzima citosolico, a dare 5beta-colestan-3alfa,7alfa,12alfa-triolo.
- Il 5beta-colestan-3alfa,7alfa,12alfa-triolo subirà l’ossidazione della catena laterale in tre reazioni catalizzate dalla sterolo 27-idrossilasi o CYP27A1 (EC 1.14.15.15). Si tratta di un enzima mitocondriale presente anche in tessuti extraepatici e nei macrofagi, che introduce un gruppo ossidrilico in posizione 27. Il gruppo ossidrilico è poi ossidato ad aldeide e quindi ad acido carbossilico, con formazione di acido 3alfa,7alfa, 12alfa-triidrossi-5beta-colestanoico.
- L’acido 3alfa,7alfa, 12alfa-triidrossi-5beta-colestanoico è attivato a seguito del legame con il coenzima A, nella reazione catalizzata dagli enzimi BACS, acronimo dell’inglese bile acid CoA synthetase (EC 6.2.1.7), o VLCS, acronimo dell’inglese very long chain acyl CoA synthetase (EC 6.2.1.-), entrambe localizzati nel reticolo endoplasmatico.
- Il 3alfa,7alfa,12alfa-triidrossi-5beta-colestanoilCoA è trasportato nei perossisomi dove va incontro a 5 reazioni consecutive, catalizzate da altrettanti enzimi differenti. Nelle ultime due la catena laterale è accorciata a quattro atomi di carbonio e viene prodotto il colilCoA.
- L’ultimo passaggio coinvolge la coniugazione, attraverso legame ammidico, del gruppo carbossilico terminale della catena laterale con l’aminoacido glicina o taurina, nella reazione catalizzata da BAAT, acronimo dell’inglese bile acid-CoA:amino acid N-acyltransferase (EC 2.3.1.65), enzima a localizzazione prevalentemente perossisomiale.
I prodotti della reazione saranno quindi gli acidi biliari coniugati glicocolico e taurocolico.
Nel caso in cui il 7alfa-idrossi-4-colesten-3-one non entri nella reazione catalizzata dalla sterolo 12alfa-idrossilasi prenderà la via che porta alla sintesi dei coniugati dell’acido chenodesossicolico attraverso le reazioni di seguito descritte.
- Il 7alfa-idrossi-4-colesten-3-one viene convertito in 7alfa-idrossi-5β-colestan-3-one nella reazione catalizzata dall’enzima 3-osso-Δ4-steroide 5beta-reduttasi.
- Il 7alfa-idrossi-5β-colestan-3-one nella reazioni dalla 3alfa-idrossisteroide deidrogenasi, viene convertito in 5beta-colestan-3alfa,7alfa-diolo.
Quindi, a seguito di modificazione analoghe a quelle viste per la sintesi dei coniugati dell’acido colico, e catalizzate per la maggior parte dagli stessi enzimi, si formeranno gli acidi biliari coniugati glicochenodesossicolico e taurochenodesossicolico.
Nota: gli acidi biliari deconiugati a livello intestinale dovranno raggiungere il fegato per essere riconiugati.
La via alternativa o acida
E’ prevalente nel feto e nel neonato, mentre nell’adulto porta alla sintesi di meno del 10% dei sali biliari.
Questa via si differenzia da quella classica, in quanto:
- i prodotti intermedi sono acidi, per cui viene definita anche come “via acida”;
- l’ossidazione della catena laterale precede le modificazioni del nucleo steroideo;
- i prodotti finali sono i coniugati dell’acido chenodesossicolico.
Il primo passaggio comporta la conversione del colesterolo in 27-idrossicolesterolo nella reazione catalizzata dalla sterolo 27-idrossilasi.
A questo punto sono possibili due vie.
Via A
- In una reazione catalizzata dalla sterolo 27-idrossilasi, il 27-idrossicolesterolo è convertito in acido 3beta-idrossi-5-colestenoico.
- L’acido 3beta-idrossi-5-colestenoico nella reazione catalizzata dalla ossisterolo 7α-idrossilasi o CYP7B1 (EC 1.14.13.100), un enzima del reticolo endoplasmatico, viene idrossilato in posizione 7 a dare l’acido 3beta-7alfa-diidrossi-5-colestenoico.
- L’acido 3beta-7alfa-diidrossi-5-colestenoico viene convertito in acido 3-osso-7alfa-idrossi-4-colestenoico, nella reazione catalizzata dalla 3beta-idrossi-Δ5-C27-steroide ossidoreduttasi.
- L’acido 3-osso-7alfa-idrossi-4-colestenoico, a seguito di modificazioni della catena laterale, darà origine all’acido chenodesossicolico e quindi ai suoi coniugati.
Via B
- Il 27-idrossicolesterolo è convertito in 7alfa,27-diidrossicolesterolo nella reazione catalizzata dalla ossisterolo 7alfa-idrossilasi e colesterolo 7alfa-idrossilasi.
- Il 7alfa,27-diidrossicolesterolo è convertito in 7alfa,26-diidrossi-4-colesten-3-one nella reazione catalizzata dalla 3beta-idrossi-Δ5-C27-steroide ossidoreduttasi.
- Il 7alfa,26-diidrossi-4-colesten-3-one può ora proseguire come tale o essere convertito in acido 3-osso-7alfa-idrossi-4-colestenoico e subire le modifiche alla catena laterale e le altre reazioni che portano alla sintesi dei coniugati dell’acido chenodesossicolico.
Le vie minori
Esistono anche vie minori che possono contribuire, sebbene in misura ridotta, alla sintesi degli acidi biliari.
Ad esempio:
- Nel fegato viene espressa una colesterolo 25-idrossilasi (EC 1.14.99.38).
- Nel cervello è espressa una colesterolo 24- idrossilasi o CYP46A1 (EC 1.14.14.25), e quindi, sebbene l’organo non sia in grado di esportare colesterolo, può esportare ossisteroli.
- E’ stata scoperta anche una 7alfa-idrossilasi non specifica espressa in tutti i tessuti, che sembra essere coinvolta nella generazione di ossisteroli che possono poi essere trasportati al fegato per essere convertiti in acido chenodesossicolico.
Inoltre, la sterolo 27-idrossilasi è espressa in vari tessuti, per cui i suoi prodotti di reazione possono essere trasportati al fegato ed essere convertiti in sali biliari.
Regolazione della sintesi degli acidi biliari
La regolazione avviene attraverso un feedback negativo, in particolare sull’espressione degli enzimi colesterolo 7alfa-idrossilasi e sterolo 12alfa-idrossilasi.
In caso di eccesso di acidi biliari, sia coniugati che liberi, gli stessi si vanno a legare al recettore nucleare FRX, acronimo dell’inglese farnesoid X receptor, attivandolo. L’acido biliare più efficace nell’attivare FRX è l’acido chenodesossicolico, mentre altri, come l’acido ursodesossicolico non lo attivano.
FRX induce l’espressione del repressore trascrizionale SHP, acronimo dell’inglese small heterodimer partner, che a sua volta interagisce con altri fattori trascrizionali, come LRH-1, acronimo dell’inglese liver receptor homolog-1, e HNF-4alfa, acronimo dell’inglese hepatocyte nuclear factor-4alfa, che si legano ad una sequenza presente nella regione del promotore dei geni per la 7alfa-idrossilasi e 12alfa-idrossilasi, regione definita BAREs, acronimo dell’inglese bile acid response elements, inibendone la trascrizione.
Uno dei motivi per cui la sintesi dei sali biliari è strettamente regolata è perché molti dei loro metaboliti sono tossici.
Bibliografia
- Chiang J.Y.L. Bile acids: regulation of synthesis. J Lipid Res 2009;50(10):1955-1966. doi:10.1194/jlr.R900010-JLR200
- Gropper S.S., Smith J.L. Advanced nutrition and human metabolism. 6th Edition. Cengage Learning, 2012
- Moghimipour E., Ameri A., and Handali S. Absorption-enhancing effects of bile salts. Molecules 2015;20(8); 14451-14473. doi:10.3390/molecules200814451
- Monte M.J., Marin J.J.G., Antelo A., Vazquez-Tato J. Bile acids: Chemistry, physiology, and pathophysiology. World J Gastroenterol 2009;15(7):804-816. doi:10.3748/wjg.15.804
- Rosenthal M.D., Glew R.H. Medical biochemistry – Human metabolism in health and disease. John Wiley J. & Sons, Inc., Publication, 2009
- Sundaram S.S., Bove K.E., Lovell M.A. and Sokol R.J. Mechanisms of Disease: inborn errors of bile acid synthesis. Nat Clin Pract Gastroenterol Hepatol 2008;5(8):456-468. doi:10.1038/ncpgasthep1179