Il ciclo di Cori fu scoperto negli anni 30 e 40 del secolo scorso dai coniugi Carl e Gerty Cori, i quali scoprirono l’esistenza di una cooperazione metabolica tra il muscolo scheletrico che lavora in condizioni di limitata disponibilità di ossigeno e il fegato.[1]
Il ciclo permette la conversione del lattato, la forma in cui l’acido lattico è quasi esclusivamente presente a pH fisiologico, in glucosio, assicurando così un continuo apporto del monosaccaride ai tessuti periferici. La sua importanza è testimoniata anche dal fatto che è responsabile di circa il 40% del turn over del glucosio plasmatico.[7][8]
Dal punto di vista biochimico, il ciclo di Cori connette la glicolisi anaerobica con la gluconeogenesi, utilizzando tessuti differenti per compartimentalizzare processi opposti.[10]
Questa cooperazione metabolica è stata dimostrata esistere anche tra il fegato e tessuti extraepatici diversi dal muscolo scheletrico. Si può infatti affermare che, come per il ciclo glucosio-alanina, al ciclo di Cori possono partecipare i tessuti che non ossidino completamente il glucosio a CO2 e H2O.[11]
Indice
- Tappe
- Costo energetico
- Il ciclo di Cori è un ciclo futile?
- Ciclo di Cori e ciclo glucosio-alanina
- Bibliografia
Tappe
Di seguito sono riassunte le tappe del ciclo di Cori, considerando il lattato prodotto dalle fibre muscolari o dal globulo rosso.[12]
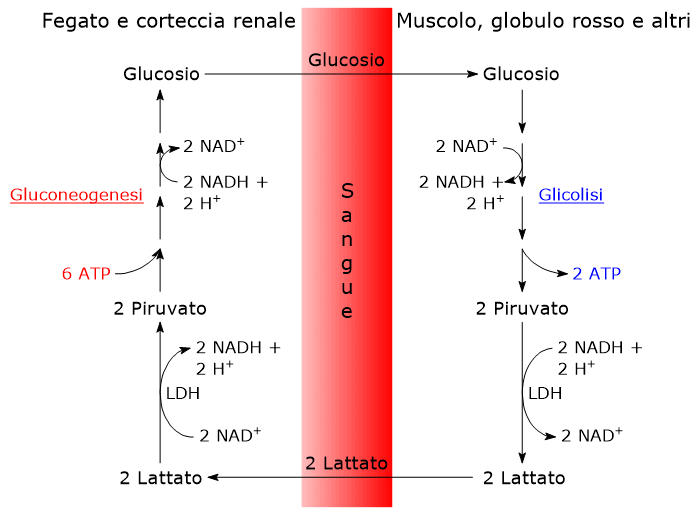
- Il ciclo ha inizio con la conversione del glucosio a lattato, attraverso la glicolisi anaerobica e la successiva azione della lattato deidrogenasi (EC 1.1.1.27), che catalizza la riduzione del piruvato, la base coniugata dell’acido piruvico.
- Segue la diffusione del lattato dalla cellula al circolo sanguigno, grazie al quale raggiunge, tra gli altri, il fegato, che è il suo principale utilizzatore, e la corteccia renale, in particolare i tubuli prossimali, essendo questi un altro sito dove avviene la gluconeogenesi.
- Nel fegato e nella corteccia renale si verifica l’ossidazione, catalizzata dalla lattato deidrogenasi, del lattato a piruvato, che è quindi convertito a glucosio a mezzo della via gluconeogenica.[8]
- Infine il glucosio prodotto diffonde nel circolo sanguigno, grazie al quale potrà raggiungere i globuli rossi o le fibre muscolari, chiudendo il ciclo.[10][11]
Globulo rosso
I globuli rossi, essendo privi di nucleo, ribosomi e mitocondri, sono più piccoli rispetto a molte altre cellule, e le ridotte dimensioni permettono loro il passaggio attraverso gli stretti capillari. Tuttavia la mancanza dei mitocondri li rende completamente dipendenti dalla glicolisi anaerobica per la produzione di ATP, il che significa che queste cellule producono continuamente acido lattico.[8][10]
La possibilità di procedere della glicolisi, come la sua velocità, dipendono anche dalla disponibilità di NAD+. Il coenzima nella sua forma ossidata è infatti necessario per l’ossidazione della gliceraldeide-3-fosfato a 1,3-bisfosfoglicerato nella reazione catalizzata dalla gliceraldeide-3-fosfato deidrogenasi (EC 1.2.1.12).
Gliceraldeide-3-fosfato + NAD+ → 1,3-Bisfosfoglicerato + NADH + H+
L’accumulo di NADH è evitato dalla riduzione del piruvato a lattato, in una reazione catalizzata dalla lattato deidrogenasi nella quale il NADH funge da donatore di agenti riducenti, ossidandosi a NAD+.[4]
Fibre muscolari
Le fibre muscolari a contrazione rapida contengono un numero ridotto di mitocondri e, in condizioni di limitata disponibilità di ossigeno, come durante un lavoro intenso, producono notevoli quantità di acido lattico.[8] In queste condizioni infatti:
- la velocità di produzione del piruvato attraverso la via glicolitica eccede la capacità del ciclo dell’acido citrico di ossidarlo, tanto che meno del 10% del piruvato prodotto entra nel ciclo stesso;
- la velocità alla quale l’ossigeno è assunto dalle cellule non è sufficiente ad assicurare l’ossidazione aerobica di tutto il NADH formato.[3]
In tali condizioni la glicolisi anaerobica porta alla produzione di 2 molecole di ATP per molecola di glucosio, 3 se il glucosio proviene dal glicogeno muscolare, una quantità decisamente inferiore rispetto alle 29-30 molecole di ATP prodotte dalla completa ossidazione del glucosio.[9] Tuttavia la velocità con cui l’ATP è prodotto dalla glicolisi anaerobica è molto maggiore rispetto a quella ottenibile dalla completa ossidazione del glucosio.[10]
Infine, come nel globulo rosso, la reazione catalizzata dalla lattato deidrogenasi, rigenerando NAD+, permette alla glicolisi di procedere, ma produce lattato.[4]
Lattato
L’acido lattico è un prodotto finale del metabolismo, e per essere utilizzato dalla cellula deve essere convertito in piruvato.[3]
La membrana plasmatica della maggior parte delle cellule è liberamente permeabile sia al piruvato che al lattato, che possono quindi raggiungere il circolo ematico.[3] Considerando ad esempio la fibra muscolare, la quantità di lattato che lascia la cellula è maggiore rispetto a quella del piruvato grazie all’elevato rapporto NADH/NAD+ intracellulare e alle proprietà catalitiche dell’isoenzima muscolare della lattato deidrogenasi.[5]
Una volta in circolo il lattato raggiunge, tra gli altri, il fegato e la corteccia renale, dove viene ossidato a piruvato, nella reazione catalizzata dagli specifici isoenzimi della lattato deidrogenasi.
Nell’epatocita questa ossidazione è favorita dal basso rapporto NADH/NAD+ presente nel citosol. Il piruvato è quindi disponibile per entrare nella tappa successiva del ciclo di Cori, la gluconeogenesi.[3]
Il glucosio prodotto, tramite il circolo ematico raggiunge il muscolo e il globulo rosso, chiudendo così il ciclo. Ovviamente il monosaccaride raggiungerà anche tutti gli altri tessuti e cellule che lo richiedono.
Costo energetico
Il ciclo di Cori comporta un consumo netto di 4 molecole di ATP.
La parte del ciclo che comprende la gluconeogenesi consuma 6 equivalenti di ATP, nello specifico 4 ATP e 2 GTP, nelle reazioni catalizzate dagli enzimi:
- piruvato carbossilasi (EC 6.4.1.1): un ATP;
- fosfoenolpiruvato carbossichinasi (EC 4.1.1.32): un GTP;
- gliceraldeide-3-fosfato deidrogenasi: un ATP.
Poiché sono utilizzate due molecole di lattato per la sintesi di ogni molecola di glucosio, il costo totale è di 2 x 3 = 6 legami ad alta energia per molecola di glucosio.[2]
Di contro, la parte del ciclo che comprende la glicolisi anaerobica ne produce 2.
In definitiva, è richiesta più energia per produrre glucosio dall’acido lattico nel fegato e nella corteccia renale rispetto a quella ottenuta dall’ossidazione anaerobica del glucosio nei tessuti extraepatici.
Il ciclo di Cori è un ciclo futile?
La demolizione e risintesi del glucosio caratteristica del ciclo di Cori può sembrare uno spreco di energia. In realtà questo ciclo permette l’efficace funzionamento di numerose cellule extraepatiche a spese del fegato e della corteccia renale, ed è quindi forse più corretto definirlo ciclo del substrato piuttosto che ciclo futile.[10] Di seguito alcuni esempi.
Il ciclo di Cori permette di smaltire parte dell’acido lattico che i globuli rossi producono.[8]
Se si considera il muscolo scheletrico, la glicolisi anaerobica rappresenta una efficiente sorgente di ATP nel corso di un esercizio intenso. Ma questo potrebbe portare a un accumulo intracellulare di lattato, e a una pericolosa diminuzione del pH intracellulare. Ovviamente tale accumulo non si verifica, grazie anche al ciclo di Cori, che scarica parte del lattato muscolare e del costo energetico per il suo smaltimento sui tessuti gluconeogenici.[3] Ad esempio, il debito di ossigeno, il “fiatone”, che sempre si presenta dopo un’attività fisica sostenuta, è in gran parte dovuto all’aumentata richiesta di ossigeno da parte degli epatociti per sostenere l’ossidazione degli acidi grassi, il loro principale carburante, ossidazione che porterà alla produzione dell’ATP necessario per la gluconeogenesi.[6][12]
Nel corso di traumi, sepsi, ustioni, o dopo grossi interventi chirurgici, si verifica un’intensa proliferazione cellulare nelle ferite, che sono tessuti ipossici, e nel midollo osseo. Questo a sua volta risulta in una maggiore produzione di acido lattico e un aumento del flusso attraverso il ciclo di Cori e, a livello epatico, in un consumo di ATP. Una situazione simile sembra presentarsi anche in quei pazienti oncologici che vanno incontro a una progressiva perdita di peso.[2]
Il ciclo di Cori è fondamentale anche nel digiuno.[6]
Ciclo di Cori e ciclo glucosio-alanina
Tra i due cicli esistono analogie e differenze.
Il ciclo glucosio-alanina e quello di Cori sono vie metaboliche che si estendono attraverso tipi cellulari differenti e contribuiscono ad assicurare un continuo rifornimento di glucosio ai tessuti.[12] In entrambe l’ingresso nella gluconeogenesi comporta la conversione del lattato e dell’alanina in piruvato. Infine, in entrambe, il glucosio prodotto è quindi trasportato ai tessuti periferici dove la via glicolitica rigenera piruvato.[13]
Invece, la loro principale differenza consiste nell’intermedio a tre atomi di carbonio che viene riciclato: nel ciclo di Cori il carbonio torna al fegato in forma di piruvato, mentre nel ciclo glucosio-alanina in forma di alanina.[8] I cicli differiscono anche per il destino metabolico del NADH: nel ciclo di Cori funge da agente riducente nella reazione catalizzata dalla lattato deidrogenasi, mentre nel ciclo glucosio-alanina gli elettroni del coenzima sono utilizzati per la sintesi di ATP nel mitocondrio. Pertanto, un’altra differenza è che il ciclo glucosio-alanina richiede la presenza di ossigeno, mentre non la richiede il ciclo di Cori.[8]
Bibliografia
- ^ American Chemical Society National Historic Chemical Landmarks. Carl and Gerty Cori and Carbohydrate Metabolism. https://www.acs.org/education/whatischemistry/landmarks/carbohydratemetabolism.html
- ^ a b Bender D.A. Introduction to nutrition and metabolism. 3rd Edition. Taylor & Francis, 2004
- ^ a b c d e Berg J.M., Tymoczko J.L., and Stryer L. Biochemistry. 5th Edition. W. H. Freeman and Company, 2002
- ^ a b Garrett R.H., Grisham C.M. Biochemistry. 4th Edition. Brooks/Cole, Cengage Learning, 2010
- ^ Gleeson T.T. Post-exercise lactate metabolism: a comparative review of sites, pathways, and regulation. Annu Rev Physiol 1996;58:565-81. doi:10.1146/annurev.ph.58.030196.003025
- ^ a b Moran L.A., Horton H.R., Scrimgeour K.G., Perry M.D. Principles of Biochemistry. 5th Edition. Pearson, 2012
- ^ National Center for Biotechnology Information. PubChem Pathway Summary for Pathway WP1946, Cori cycle, Source: WikiPathways. https://pubchem.ncbi.nlm.nih.gov/pathway/WikiPathways:WP1946. Accessed June 12, 2024
- ^ a b c d e f g Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 6th Edition. W.H. Freeman and Company, 2012
- ^ Rich P.R. The molecular machinery of Keilin’s respiratory chain. Biochem Soc Trans 2003;31(Pt 6):1095-105. doi:10.1042/bst0311095
- ^ a b c d e Rosenthal M.D., Glew R.H. Medical biochemistry – Human metabolism in health and disease. John Wiley J. & Sons, Inc., Publication, 2009
- ^ a b Stipanuk M.H., Caudill M.A. Biochemical, physiological, and molecular aspects of human nutrition. 3rd Edition. Elsevier health sciences, 2012
- ^ a b c Voet D. and Voet J.D. Biochemistry. 4th Edition. John Wiley J. & Sons, Inc. 2011
- ^ Wu G. Amino acids: biochemistry and nutrition. CRC Press, 2010