La glicolisi, anche detta via glicolitica, dal greco glykys (“dolce”) e lysis (“sciogliere”), è la sequenza di reazioni enzimatiche che, nel citosol, anche in assenza di ossigeno, converte una molecola di glucosio in due molecole di piruvato. Questo processo è accompagnato dalla produzione di due molecole di ATP e due di NADH.[1]
La glicolisi si è evoluta prima che nell’atmosfera si accumulasse una quantità significativa di ossigeno, ed è la via metabolica con il maggior flusso di carbonio nella maggior parte degli esseri viventi. È presente in quasi tutti gli organismi.[1]
Potendo avvenire in assenza di ossigeno, la glicolisi ha svolto un ruolo cruciale nei primi due miliardi di anni dell’evoluzione della vita, rappresentando uno dei più antichi meccanismi biologici per l’estrazione di energia dalle molecole organiche. Inoltre, fornisce intermedi fondamentali sia per il catabolismo aerobico sia per numerosi processi biosintetici.[2]
Nota: la glicolisi è conosciuta anche come la via di Embden–Meyerhof–Parnas, dal nome Gustav Embden, Otto Meyerhof e Jakub Karol Parnas, i ricercatori che hanno chiarito l’intero processo nel tessuto muscolare.[3]
In Sintesi: Punti Chiave
- Definizione: sequenza di 10 reazioni enzimatiche citosoliche che, anche in assenza di ossigeno, convertono il glucosio in piruvato, con contemporanea produzione di 2 molecole di ATP e 2 di NADH.
- Destini del piruvato: in presenza di ossigeno, il piruvato può entrare nel ciclo di Krebs, mentre in assenza di ossigeno può essere convertito tramite fermentazione lattica o alcolica, rispettivamente, in lattato ed etanolo.
- Fonte di precursori: fornisce precursori per vie metaboliche differenti, quali quelle per la sintesi del glicogeno, degli acidi grassi o del 2,3-bisfosfoglicerato.
- Regolazione: mediata principalmente da tre enzimi chiave (esochinasi, fosfofruttochinasi-1 e piruvato chinasi) attraverso meccanismi allosterici, modificazioni covalenti e segnali ormonali.
Indice
- Cenni storici
- Importanza della glicolisi
- Sequenza delle reazioni
- Destino di NADH e piruvato
- Glicolisi e produzione di ATP
- Vie di alimentazione della glicolisi
- Regolazione della glicolisi
- Bibliografia
Cenni storici
Lo sviluppo della biochimica è andato di pari passo con la comprensione del metabolismo del glucosio, e in particolare della glicolisi, la prima via metabolica chiarita.[4][5]
Sebbene la delucidazione di questa via fu completata negli anni quaranta, la scoperta chiave avvenne in modo casuale nel 1897, a seguito di un problema sorto un anno prima, quando il chimico tedesco M. Hahn, nel tentativo di ottenere estratti proteici privi di cellule dal lievito, incontrò difficoltà nella loro conservazione. Un suo collega, Hans Buchner, ricordando quanto si fa per le marmellate, suggerì di aggiungere saccarosio all’estratto.[6]
Eduard Buchner, fratello di Hans, mise in pratica l’idea osservando che dalla soluzione si sviluppavano bollicine. Ne concluse che fosse in corso una fermentazione, per l’epoca una scoperta sorprendente. Sino ad allora, infatti, la fermentazione, secondo Pasteur (1860), era ritenuta inestricabilmente legata alle cellule viventi. L’esperimento di Eduard dimostrava invece che poteva avvenire anche in loro assenza. Questi risultati smentirono il dogma vitalista e diedero il via alla moderna biochimica.[7]
Per queste ricerche Eduard Buchner ricevette il premio Nobel per la Chimica nel 1907 e fu il primo di una serie di ricercatori che lo vinsero per le scoperte sulla glicolisi. In seguito fu dimostrato, lavorando con estratti muscolari, che molte reazioni della fermentazione lattica coincidevano con quelle della fermentazione alcolica, il che evidenziò l’esistenza di una unità nella biochimica.[8]
Come anticipato, la glicolisi fu poi chiarita nella prima metà del ventesimo secolo, in gran parte grazie ai lavori di Gerty e Carl Cori, Carl Neuberg, Arthur Harden, William Young, Jacob Parnas, Otto Warburg, Hans von Euler-Chelpin, Gustav Embden e Otto Meyerhof. Warburg e von Euler-Chelpin chiarirono la via nel lievito, mentre Embden e Meyerhof lo fecero nel tessuto muscolare negli anni ’30.[3]
Importanza della glicolisi
La glicolisi è essenziale per la maggior parte delle cellule, sia come fonte di energia che di precursori per altre vie metaboliche. La velocità del flusso di carbonio attraverso di essa, ossia, la quantità di glucosio convertito in piruvato nell’unità di tempo, è regolata in modo da soddisfare queste due necessità fondamentali della cellula.
Dal punto di vista energetico, sebbene sia un processo relativamente inefficiente, la via glicolitica può avvenire in assenza di ossigeno, la condizione in cui si è sviluppata la vita sulla Terra e in cui tutt’oggi molte cellule, sia eucariote che procariote, si ritrovano. Di seguito alcuni esempi.[9]
Glicolisi anaerobica
I muscoli scheletrici di molti animali mostrano la capacità di ricorrere all’anaerobiosi (o metabolismo anaerobico) durante l’attività, ossia possono funzionare in assenza di ossigeno per brevi periodi. Nel corso di esercizi molto intensi, quando il fabbisogno di ATP aumenta più rapidamente della capacità del corpo di rifornire di ossigeno il muscolo, il muscolo ricava l’energia metabolica necessaria al suo funzionamento in modo anaerobico, appunto attraverso la sola glicolisi, sebbene possa fare ciò solo per brevi periodi.
Un altro esempio è la cornea dell’occhio, un tessuto scarsamente vascolarizzato.[9]
Molti microorganismi, come quelli che vivono in ambienti quali il suolo, le profondità marine ma anche i pori della pelle, si ritrovano in zone in cui l’ossigeno è scarso. Esistono anche microrganismi, definiti anaerobi obbligati, che non possono sopravvivere in presenza di ossigeno. Esempi sono il batterio responsabile della gangrena gassosa, Clostridium perfringens, del tetano, Clostridium tetani, e del botulismo, Clostridium botulinum.[10]
Glicolisi nelle cellule glucosio-dipendenti
La glicolisi gioca un ruolo centrale anche in tutte quelle cellule e tessuti che dipendono primariamente dal glucosio quale fonte di energia, come:
- i globuli rossi, privi di mitocondri;
- le cellule spermatiche;
- il cervello (che può anche utilizzare i corpi chetonici se il glucosio scarseggia);
- la midollare del surrene.[11]
Una situazione simile si ritrova anche nel mondo vegetale. Molte piante acquatiche e alcuni tessuti vegetali specializzati nell’accumulo di amido, come i tuberi delle patate, utilizzano il glucosio come principale fonte di energia.[12]
Nota: esistono organismi, conosciuti come anaerobi facoltativi, possono sopravvivere sia in presenza che in assenza di ossigeno. Esempi sono gli animali appartenenti al genere Mytilus, che quindi mostrano un funzionamento anaerobico dipendente dall’ambiente, o anaerobico habitat-dipendente, una situazione simile a quanto visto in precedenza nel muscolo.[13]
Glicolisi aerobica
In condizioni aerobiche, nelle cellule dotate di mitocondri, la glicolisi rappresenta la parte iniziale della via metabolica che porta alla completa ossidazione del glucosio ad anidride carbonica (CO2) e acqua (H2O) a scopi energetici.[14]
Fonte di precursori biosintetici
Diversi intermedi glicolitici, come il glucosio-6-fosfato (G6P), il fruttosio-6-fosfato (F6P) e il diidrossiacetone fosfato (DHAP) possono essere utilizzati come precursori biosintetici in vie metaboliche quali ad esempio quelle che portano alla sintesi del glicogeno, degli acidi grassi, dei trigliceridi, dei nucleotidi, di alcuni amminoacidi, o del 2,3-bisfosfoglicerato (2,3-BPG).[15]
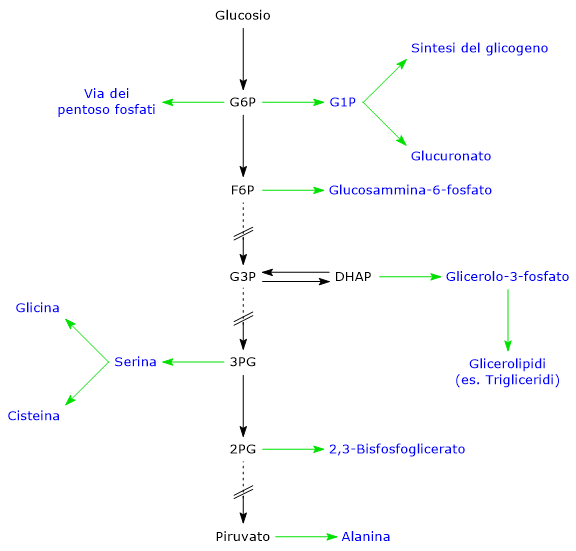
Sequenza delle reazioni
Le 10 tappe che compongono la glicolisi possono essere suddivise in due fasi.
La prima, detta fase preparatoria, si compone di 5 reazioni e comporta dapprima la conversione di una molecola di glucosio in una di fruttosio-1,6-bisfosfato (F1,6BP), attraverso tre passaggi: una fosforilazione sul C-6, una isomerizzazione e una seconda fosforilazione, stavolta sul C-1, con consumo di due molecole di ATP.
Segue la scissione del fruttosio-1,6-bisfosfato in due intermedi fosforilati a tre atomi di carbonio: la gliceraldeide-3-fosfato (G3P) e il diidrossiacetone fosfato. Infine il DHAP è isomerizzato in gliceraldeide-3-fosfato. Dunque, nella fase preparatoria una molecola di glucosio viene scissa in due di gliceraldeide-3-fosfato e si consumano due molecole di ATP.
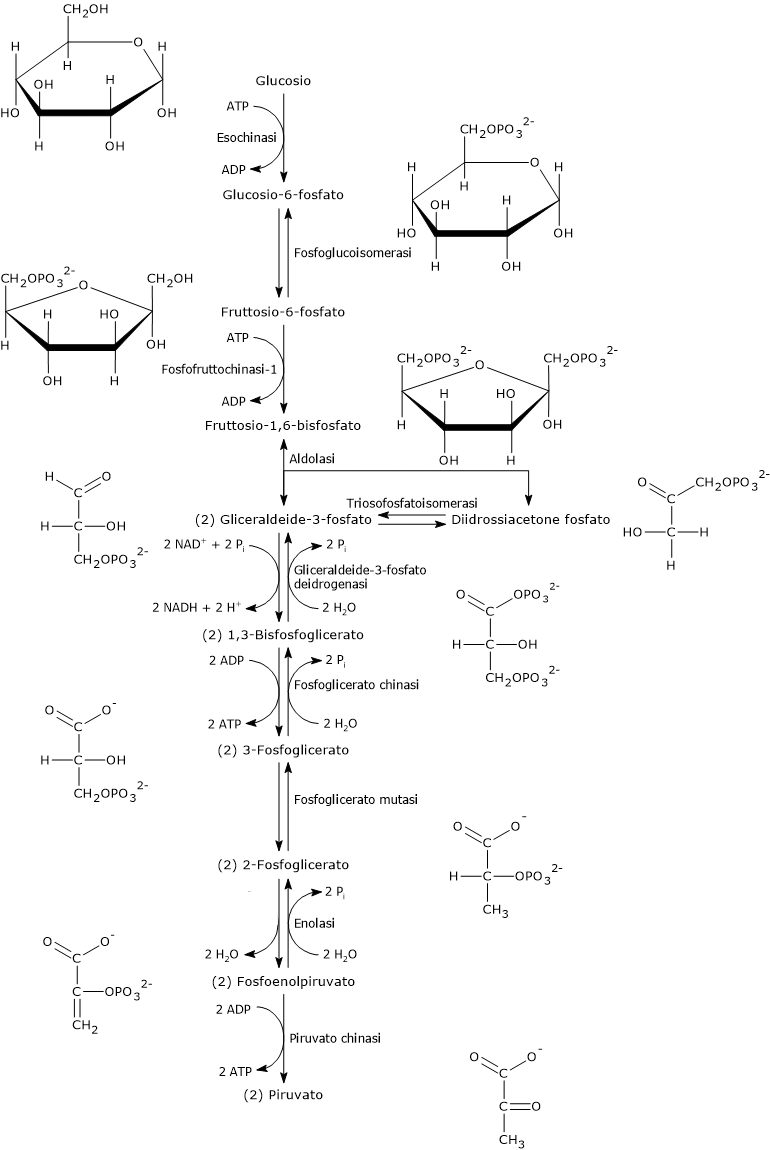
La seconda fase, detta fase di recupero energetico, è composta dalle restanti cinque reazioni. In questa fase due molecole di gliceraldeide-3-fosfato sono convertite in altrettante molecole di piruvato, con concomitante produzione di quattro molecole di ATP. Quindi nella seconda fase si verifica l’estrazione e conservazione in forma di ATP di parte dell’energia chimica presente nella molecola del glucosio. Inoltre sono estratti anche equivalenti riducenti, immagazzinati nella molecola del NADH (la forma ridotta del coenzima NAD+,nicotinammide adenina dinucleotide). Il destino del NADH dipenderà dal tipo di cellula e dalla presenza o meno di quantità adeguate di ossigeno.
Nota: nella glicolisi è metabolizzato sia il glucosio di derivazione ematica, che entra nella cellula attraverso un trasporto mediato da specifici trasportatori proteici di membrana, che il glucosio-6-fosfato derivante dalla glicogenolisi.[11]
Reazione 1
Nella prima tappa della via glicolitica il glucosio viene fosforilato a glucosio-6-fosfato a spese di una molecola di ATP.
Glucosio + ATP → G6P + ADP
Nella maggior parte delle cellule questa reazione è catalizzata dalla esochinasi (EC 2.7.1.1), enzima presente nelle cellule di tutti gli organismi. Negli esseri umani è presente con quattro forme isoenzimatiche.[16] L’esochinasi e la piruvato chinasi (EC 2.7.1.40), due delle chinasi della glicolisi, richiedono per la loro attività la presenza dello ione magnesio (Mg2+) o dello ione manganese (Mn2+). Considerando Mg2+, questi si va a legare all’ATP a formare il complesso MgATP2−, che è il vero substrato dell’enzima piuttosto che il solo ATP. L’attacco nucleofilo da parte di un gruppo idrossilico (–OH) del glucosio all’atomo di fosforo terminale (γ) dell’ATP è facilitato dall’azione degli ioni magnesio che vanno a interagire con le cariche negative dei gruppi fosforici del nucleoside trifosfato.
La formazione del legame fosfoestereo tra un gruppo fosforico e il gruppo ossidrilico sul C-6 è termodinamicamente sfavorita. Tuttavia, accoppiando la reazione con l’idrolisi dell’ATP, la reazione complessiva diviene favorita e procede.[3]
Energetica e irreversibilità
In assenza di ATP, la fosforilazione diretta del glucosio sul C-6 a opera del solo fosfato inorganico (Pi) è endoergonica, con una variazione di energia libera di Gibbs standard (ΔG°’) pari a +3,3 kcal/mol (+13,8 kJ/mol). L’idrolisi dell’ATP a dare ADP e Pi ha un ΔG°’ pari −7,3 kcal/mol (−30,5 kJ/mol), ossia è una reazione esoergonica. Il ΔG°’ della reazione accoppiata sarà di −4,0 kcal/mol (−16,7 kJ/mol).
In condizioni fisiologiche la reazione è anche più favorevole, con un ΔG pari a circa −8,0 kcal/mol (−33,5 kJ/mol). Dunque si tratta di una reazione essenzialmente irreversibile.[17]
Nota: in biochimica le fosforilazioni sono reazioni fondamentali, catalizzate da enzimi detti chinasi, una sottoclasse delle transferasi. Le chinasi catalizzano il trasferimento del gruppo fosforico terminale di un nucleoside trifosfato (in genere l’ATP) a un nucleofilo accettore, a formare un legame fosfoestereo. Nello specifico, le esochinasi catalizzano il trasferimento del gruppo fosforico in posizione γ dell’ATP a vari zuccheri a sei atomi di carbonio tra cui, oltre ovviamente al glucosio, anche al fruttosio e al mannosio.[5]
| Fase | Dettagli |
|---|---|
| Reazione | Glucosio + ATP → G6P + ADP |
| Enzima | Esochinasi. Nell’uomo: quattro isoforme. |
| Cofattori | Mg2+ (come MgATP2−) oppure Mn2+ |
| ΔG°′ | –16,7 kJ/mol (netto) (–4,0 kcal/mol) |
| ΔG | ≈ –33,5 kJ/mol (–8,0 kcal/mol) |
| Reversibilità | Irreversibile in condizioni fisiologiche |
Reazione 2
Nella seconda tappa della glicolisi si verifica l’isomerizzazione del G6P, un aldoso, a fruttosio-6-fosfato, un chetoso.
G6P ⇄ F6P
La reazione è catalizzata dalla fosfoglucosio isomerasi (anche nota come glucosio-6-fosfato isomerasi; EC 5.3.1.9). Come l’esochinasi, anche la fosfoglucosio isomerasi necessita della presenza di Mg2+.
Glucosio-6-fosfato e fruttosio-6-fosfato sono un esempio di isomeria di gruppo funzionale.
Il ΔG°’ della reazione è pari a +0,4 kcal/mol (+1,7 kJ/mol), mentre il ΔG è di circa −0,6 kcal/mol (−2,5 kJ/mol). Questo piccolo valore sta a indicare che la reazione è prossima all’equilibrio ed è facilmente reversibile.
La reazione consiste essenzialmente nel passaggio del gruppo carbonilico presente sul C-1 della forma a catena aperta del glucosio-6-fosfato al C-2 della forma a catena aperta del fruttosio-6-fosfato.[3]
Meccanismo e importanza
La reazione può essere suddivisa in tre passaggi.
L’enzima innanzitutto apre l’anello del glucosio-6-fosfato, poiché entrambi gli esosi sono presenti principalmente in forma ciclica in soluzione acquosa.
Successivamente catalizza l’isomerizzazione dell’intermedio a catena aperta, spostando il gruppo carbonilico dal C-1 al C-2.
Infine, favorisce la chiusura dell’anello, a dare il fruttosio-6-fosfato, che adotta una struttura furanosica a cinque atomi.[5]
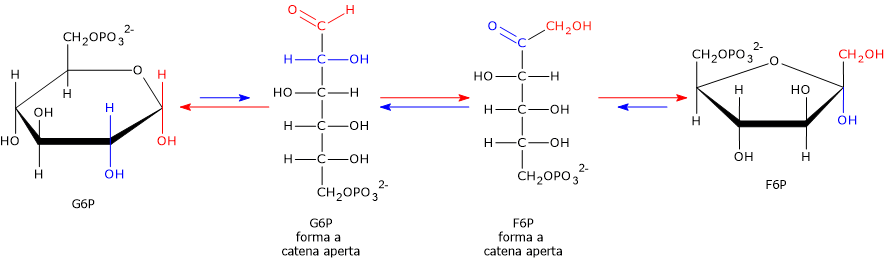
Questa reazione di isomerizzazione è un passaggio cruciale per glicolisi in quanto prepara per le due tappe successive.
Perché?
- La fosforilazione che si verifica nella reazione successiva, la terza, richiede la presenza di un gruppo idrossilico sul C-1, e non di un gruppo carbonilico.
- Nella quarta tappa si verifica la scissione del legame tra il C-3 e il C-4, scissione facilitata dalla presenza del gruppo carbonilico sul C-2.[11]
| Fase | Dettagli |
|---|---|
| Reazione | G6P ⇄ F6P |
| Enzima | Fosfoglucosio isomerasi |
| Cofattori | Mg2+ |
| ΔG°′ | +1,7 kJ/mol (+0,4 kcal/mol) |
| ΔG | ≈ –2,5 kJ/mol (–0,6 kcal/mol) |
| Reversibilità | Reversibile (vicina all’equilibrio) |
Reazione 3
Nella terza tappa della glicolisi avviene una seconda fosforilazione nella quale il F6P viene fosforilato sul C-1 a dare fruttosio-1,6-bisfosfato, a spese di una molecola di ATP.
F6P + ATP → F1,6BP + ADP
La reazione è catalizzata dalla fosfofruttochinasi-1 (PFK-1; EC 2.7.1.11), così chiamata per distinguerla dalla fosfofruttochinasi-2 (PFK-2; EC 2.7.1.105), che catalizza la fosforilazione del fruttosio-6-fosfato a fruttosio-2,6-bisfosfato.[1]
Come la reazione catalizzata dalla esochinasi, anche questa fosforilazione ATP-dipendente è essenzialmente irreversibile, grazie all’accoppiamento con l’idrolisi dell’ATP. Infatti la fosforilazione del fruttosio-6-fosfato a opera del solo fosfato inorganico è una reazione endoergonica (ΔG°’ = +3,9 kcal/mol, +16,3 kJ/mol), mentre, quando è accoppiata all’idrolisi dell’ATP, la reazione complessiva diviene esoergonica (ΔG°’ = −3,4 kcal/mol,−14,2 kJ/mol; ΔG ≈ −5,3 kcal/mol, −22,2 kJ/mol).[3]
Mentre la esochinasi permette alla cellula di “intrappolare” il glucosio al suo interno, PFK-1 evita che il suo scheletro carbonioso sia utilizzato per la sintesi del glicogeno o per la produzione di altri zuccheri, ma venga invece metabolizzato nella via glicolitica. Infatti, a differenza del glucosio-6-fosfato, il fruttosio-1,6-bisfosfato è un metabolita esclusivo della glicolisi/gluconeogenesi. In altri termini, la fosfofruttochinasi-1 catalizza la prima tappa di comando della via glicolitica.
Reazioni di questo tipo sono generalmente catalizzate da enzimi regolati allostericamente, la cui modulazione impedisce l’accumulo sia dei prodotti intermedi che di quelli finali. La PFK-1 non fa eccezione, essendo soggetta a una fine regolazione allosterica da parte di numerosi metaboliti che segnalano il livello di energia e lo stato ormonale dell’organismo.[5]
| Fase | Dettagli |
|---|---|
| Reazione | F6P + ATP → F1,6BP + ADP |
| Enzima | Fosfofruttochinasi-1 (PFK-1) |
| Cofattori | Mg2+ (come MgATP2–) |
| ΔG°′ | –14,2 kJ/mol (–3,4 kcal/mol) |
| ΔG | ≈ –22,2 kJ/mol (–5,3 kcal/mol) |
| Reversibilità | Irreversibile (prima tappa esclusiva della glicolisi) |
Fosfofruttochinasi-1 PPi-dipendente
Alcuni batteri e protisti, e forse tutte le piante, hanno una fosfofruttochinasi che utilizza come donatore del gruppo fosforico non l’ATP ma il pirofosfato (PPi). Questa reazione ha un un ΔG°’ pari a −2,9 kcal/mol (−12,1kJ/mol).[18]
F6P + PPi → F1,6BP + Pi
Reazione 4
Nella quarta tappa della via glicolitica si verifica la scissione reversibile del F1,6BP in gliceraldeide-3-fosfato, un aldoso, e diidrossiacetone fosfato, un chetoso. La reazione è catalizzata dalla fruttosio-1,6-bisfosfato aldolasi o semplicemente aldolasi (EC 4.1.2.13). L’enzima catalizza la scissione del legame tra il C-3 e il C-4 del fruttosio.[1]
F1,6BP ⇄ DHAP + G3P
Tutti gli intermedi glicolitici a valle di questa reazione sono molecole a tre atomi di carbonio anziché a sei come le precedenti.[11]
Nota: l’enzima aldolasi deriva il proprio nome dalla reazione inversa, ovvero la condensazione di un’aldeide e di un chetone per formare un β-idrossichetone (un aldolo), in un processo noto come condensazione aldolica.
Energetica e reversibilità
Il ΔG°’ della reazione nella direzione della produzione di gliceraldeide-3-fosfato e diidrossiacetone fosfato è positivo, pari a +5,7 kcal/mol (+23,8 kJ/mol), mentre la costante di equilibio (Keq) è pari a circa 10−4 M. Questi valori indicano che la reazione, in condizioni standard, non procede da sinistra verso destra. Tuttavia, nel contesto cellulare, i prodotti vengono rapidamente consumati nelle reazioni successive, mantenendo le loro concentrazioni a bassi livelli. Di conseguenza, il ΔG è pari a −0,3 kcal/mol (−1,3 kJ/mol), un valore molto piccolo, per cui la reazione è facilmente reversibile, ossia è essenzialmente all’equilibrio.[5]
| Fase | Dettagli |
|---|---|
| Reazione | F1,6BP ⇄ DHAP + G3P |
| Enzima | Aldolasi (fruttosio-1,6-bisfosfato aldolasi) |
| ΔG°′ | +23,8 kJ/mol (+5,7 kcal/mol) |
| ΔG | ≈ –1,3 kJ/mol (–0,3 kcal/mol) |
| Reversibilità | Reazione vicina all’equilibrio; facilmente reversibile |
| Nota | Il nome dell’enzima deriva dalla reazione inversa, una condensazione aldolica |
Reazione 5
Dei due prodotti della reazione catalizzata dalla aldolasi, la gliceraldeide-3-fosfato si trova sulla via diretta della glicolisi, al contrario del DHAP che come tale non può proseguire. Per farlo deve essere convertito, isomerizzato, a gliceraldeide-3-fosfato. Questa isomerizzazione avviene nella reazione catalizzata dalla trioso fosfato isomerasi (EC 5.3.1.1).
DHAP ⇄ G3P
La trioso fosfato isomerasi catalizza il trasferimento di un atomo d’idrogeno dal C-1 a C-2, ossia una tautomerizzazione cheto-enolica. In pratica l’enzima fa si che i carboni C-1, C-2 e C-3 della molecola di glucosio di partenza divengano equivalenti rispettivamente ai carboni C-6, C-5 e C-4.
Il risultato netto dell’azione della aldolasi e della trioso fosfato isomerasi è dunque la produzione di due molecole di gliceraldeide-3-fosfato.[3]
Il ΔG°’ della reazione è pari a +1,8 kcal/mol (+7,5 kJ/mol), mentre il ΔG è pari a +0,6 kcal/mol (+2,5 kJ/mol). All’equilibrio, circa il 96% del triosofosfato presente sarebbe rappresentato dal diidrossiacetone fosfato. Tuttavia ciò non accade, e la reazione procede rapidamente verso la formazione della gliceraldeide-3-fosfato grazie alla tappa successiva della glicolisi che rimuove rapidamente la gliceraldeide-3-fosfato prodotta.[1]
Una delle caratteristiche distintive della trioso fosfato isomerasi è la sua straordinaria efficienza catalitica. L’enzima è infatti considerato cineticamente “perfetto”. Perché?
Se si considera la velocità con cui avviene l’isomerizzazione in presenza di un catalizzatore basico, come può essere l’acetone, l’enzima è in grado di accelerarla di un fattore 1010. Infatti, analizzando il rapporto Kcat/KM, questi è pari a 2×108 M−1s−1, valore prossimo alla limite controllato dalla diffusione. Quindi, il passaggio limitante la velocità non è la chimica della reazione stessa, ma la velocità con cui enzima e substrato si incontrano.[19]
Energetica e rilevanza metabolica
Dal punto di vista termodinamico, le reazioni 4 e 5 della glicolisi sono sfavorevoli, con un ΔG°’ di +7,5 kcal/mol (+31,3 kJ/mol). Tuttavia, il ΔG°’complessivo della fase preparatoria (reazioni 1–5) è pari a +0,5 kcal/mol (+2,1 kJ/mol), con una Keq complessiva di circa 0,43. Ed è l’energia libera derivante dall’idrolisi delle due molecole di ATP che, in condizioni standard, sposta la costante di equilibrio complessiva vicino a uno.
Di contro, in condizioni fisiologiche, il ΔG questi è ampiamente negativo, pari a circa −13,6 kcal/mol (−56,8 kJ/mol), il che assicura che la via proceda in avanti.[17]
Il DHAP può anche fungere da precursore nel metabolismo lipidico. Può essere infatti ridotto a glicerolo 3-fosfato dalla glicerolo 3-fosfato deidrogenasi citosolica (EC 1.1.1.8).
DHAP + NADH + H+ ⇄ Glicerolo-3-fosfato + NAD+
L’enzima fa da ponte tra il metabolismo glucidico e lipidico in quanto il glicerolo-3-fosfato prodotto è utilizzato nella sintesi di lipidi come i trigliceridi.
Questa via è particolarmente importante nel tessuto adiposo e nell’intestino tenue, dove rappresenta una fonte importante di glicerolo-3-fosfato.[11]
| Fase | Dettagli |
|---|---|
| Reazione | DHAP ⇄ G3P |
| Enzima | Trioso fosfato isomerasi |
| ΔG°′ | +7,5 kJ/mol (+1,8 kcal/mol) |
| ΔG | ≈ +2,5 kJ/mol (+0,6 kcal/mol), ma la reazione procede in avanti grazie al rapido consumo del G3P |
| Equilibrio | ≈ 96% DHAP all’equilibrio |
| Efficienza catalitica | Cineticamente “perfetta”: Kcat/KM ≈ 2 × 108 M–1s–1 |
| Ruolo aggiuntivo | Il DHAP può essere ridotto a glicerolo-3-fosfato, collegando la glicolisi al metabolismo dei lipidi |
Reazione 6
Nella sesta tappa della via glicolitica, la prima fase di recupero energetico, si verifica l’ossidazione della G3P a dare 1,3-bisfosfoglicerato (1,3-BPG) e la concomitante riduzione del NAD+ a NADH. La reazione è catalizzata dalla gliceraldeide-3-fosfato deidrogenasi (EC 1.2.1.12).[3]
G3P + NAD+ + Pi ⇄ 1,3-BPG + NADH + H+
Questa reazione è la prima delle due tappe della glicolisi in cui viene resa disponibile l’energia chimica necessaria per la successiva sintesi dell’ATP.
Meccanismo ed energetica
La reazione complessiva è la somma di due processi.
- Nel primo si verifica l’ossidazione del gruppo aldeidico della G3P a gruppo carbossilico, passaggio nel quale il NAD+ funge da agente ossidante. La reazione è fortemente esoergonica (∆G’° = −10,3 kcal/mol, −43,1 kJ/mol).
- Nel secondo si verifica una fosforilazione, ossia la formazione di un legame tra il fosfato inorganico e il gruppo carbossilico sul C-1 dell’1,3-bisfosfoglicerato a dare un’anidride mista, detta acil fosfato. Questa reazione è fortemente endoergonica (∆G’° = +11,8 kcal/mol, +49,3 kJ/mol).[11]
Per consentire la formazione dell’acil fosfato, le due reazioni devono essere accoppiate, non successive. In questo modo l’ossidazione dell’aldeide viene utilizzata per guidare la formazione dell’anidride mista, con un ΔG°’ complessivo leggermente endoergonico, +1,5 kcal/mol (+6,3 kJ/mol), mentre il valore del ΔG è +0,6 kcal/mol (+2,5 kJ/mol).[17]
Dunque la maggior parte dell’energia libera derivante dall’ossidazione del gruppo aldeidico anziché dissiparsi in calore viene conservata nella formazione del legame acil fosfato dell’1,3-BPG.[20]
| Aspetto | Dettagli |
|---|---|
| Reazione | G3P + NAD+ + Pi ⇄ 1,3-BPG + NADH + H+ |
| Enzima | Gliceraldeide-3-fosfato deidrogenasi |
| Cofattore | NAD+ (ridotto a NADH) |
| ΔG°′ | +6,3 kJ/mol (+1,5 kcal/mol) |
| ΔG | ≈ +2,5 kJ/mol (+0,6 kcal/mol) |
| Importanza | Prima tappa di conservazione dell’energia; formazione di un legame acilfosfato ad alta energia |
Nota sulla riduzione del NAD+
La riduzione reversibile dell’anello nicotinammidico del NAD+ o NADP+ deriva dalla perdita di due atomi d’idrogeno da parte di un’altra molecola, in questo caso il gruppo aldeidico della gliceraldeide-3-fosfato, che quindi si ossida, e al successivo trasferimento di uno ione idruro, ossia due elettroni e un protone (2 e− + H+), all’anello suddetto. L’H+ rimanente è rilasciato nel mezzo acquoso.[5]
Di seguito le semireazioni per entrambe i coenzimi.
NAD+ + 2 e– + 2 H+ → NADH + H+
NADP+ + 2 e– + 2 H+ → NADPH + H+
Reazione 7
Nella settima tappa della glicolisi si verifica il trasferimento del gruppo fosforico ad alta energia dall’acil fosfato dell’1,3-BPG all’ADP con formazione di ATP e 3-fosfoglicerato (3-PG). La reazione è catalizzata dalla fosfoglicerato chinasi (EC 2.7.2.3).[1]
1,3-BPG + ADP ⇄ 3-PG + ATP
Il ΔG°’ della reazione è pari a −4,4 kcal/mol (−18,5 kJ/mol), quindi si tratta di una reazione esoergonica. Il ΔG è pari a +0,3 kcal/mol (+1,3 kJ/mol).[17]
Energetica e reversibilità
L’elevato potenziale di trasferimento del gruppo fosforico dell’acil fosfato viene sfruttato per la fosforilazione dell’ADP, un processo definito fosforilazione a livello del substrato. In altri termini, parte dell’energia rilasciata nel corso dell’ossidazione del gruppo aldeidico nel passaggio precedente viene ora conservata attraverso la formazione di ATP.[5]
La reazione catalizzata dalla fosfoglicerato chinasi è la prima delle due reazione della glicolisi in cui parte dell’energia chimica presente nella molecola del glucosio viene conservata in forma di ATP. Poiché dall’azione dell’aldolasi e della trioso fosfato isomerasi, reazione 4 e 5, si formano due molecole di gliceraldeide-3-fosfato per molecola di glucosio, in questo passaggio sono prodotte due molecole di ATP che vanno a “pareggiare” le due molecole di ATP consumate nella fase preparatoria (reazioni 1 e 3).
La fosfoglicerato chinasi prende il nome dalla reazione che procede nella direzione opposta rispetto a quella appena descritta, ossia la fosforilazione del 3-fosfoglicerato a dare 1,3-bisfosfoglicerato a spese di una molecola di ATP. L’enzima infatti, al pari di tutti gli altri enzimi, è in grado di catalizzare la reazione in entrambe le direzioni. La direzione inversa si verifica durante la fissazione fotosintetica della CO2 e la gluconeogenesi.[21]
| Fase | Dettagli |
|---|---|
| Reazione | 1,3-BPG + ADP ⇄ 3-PG + ATP |
| Enzima | Fosfoglicerato chinasi |
| ΔG°′ | −18,5 kJ/mol (−4,4 kcal/mol) |
| ΔG | ≈ +1,3 kJ/mol (+0,3 kcal/mol) |
| Processo | Fosforilazione a livello del substrato; formazione di ATP a partire dal legame acilfosfato ad alta energia del 1,3-BPG |
| Resa di ATP | 2 ATP per molecola di glucosio (poiché 2 molecole di G3P entrano nella fase di rendimento) |
| Importanza | Prima tappa di formazione di ATP nella glicolisi; compensa l’ATP consumato nella fase preparatoria |
| Reversibilità | Reazione reversibile; la direzione inversa avviene nella gluconeogenesi e nella fotosintesi |
Accoppiamento con la reazione 6
La reazione 6 e la 7 nel loro insieme rappresentano un processo di accoppiamento energetico, in cui l’intermedio comune è rappresentato dall’1,3-BPG.
Mentre la reazione che porta alla sintesi dell’1,3-bisfosfoglicerato è endoergonica (ΔG°’ = +1,5 kcal/mol, +6,3 kJ/mol), la successiva è esoergonica (ΔG°’ = −4,4 kcal/mol, −18,5 kJ/mol). Il ΔG°’ complessivo è pari a −2,9 kcal/mol (−12,2 kJ/mol), ossia la razione catalizzata dalla fosfoglicerato chinasi è sufficientemente esoergonica da “trascinare” anche la precedente, rendendo la reazione complessiva esoergonica.
G3P + ADP + Pi + NAD+ ⇄ 3-PG + ATP + NADH
In verità, la reazione della fosfoglicerato chinasi è sufficientemente esoergonica da accoppiare positivamente dal punto di vista termodinamico anche le reazioni catalizzate dalla aldolasi e dalla trioso fosfato isomerasi.
Poiché l’energia libera standard d’idrolisi del gruppo fosforico sul C-3 del 3-fosfoglicerato è pari a −3 kcal/mol (−12,5 kJ/mol), non è possibile alcuna sintesi di ATP. Le due reazioni successive della glicolisi porteranno alla conversione del 3-fosfoglicerato in fosfoenolpiruvato (PEP), una molecola con un potenziale di trasferimento del gruppo fosforico sufficientemente alto da permettere la sintesi di ATP.[3]
Reazione 8
Nell’ottava tappa della glicolisi il 3-PG viene convertito in 2-fosfoglicerato (2-PG) in una reazione reversibile catalizzata dalla fosfoglicerato mutasi (EC 5.4.2.1). La reazione richiede la presenza di Mg2+ e ha un ΔG molto basso, pari a circa +0,2 kcal/mol (+0,8 kJ/mol) e un ΔG°’ pari a +1,1 kcal/mol (+4,4 kJ/mol).[17]
La fosfoglicerato mutasi appartiene alla classe delle mutasi, enzimi che catalizzano lo spostamento intramolecolare di un gruppo chimico, in questo caso del gruppo fosforico dal C-3 al C-2 del 3-fosfoglicerato. A loro volta le mutasi sono una sottoclasse delle isomerasi.[22]
3-PG ⇄ 2-PG
Meccanismo e significato
Il meccanismo con cui si svolge questa reazione dipende dal tipo di organismo considerato. Ad esempio, nel lievito o nel muscolo di coniglio la reazione avviene in due passaggi e comporta la formazione di un intermedio fosfo-enzima.
Nella prima parte della reazione un gruppo fosforico legato covalentemente a un residuo di istidina presente nel sito attivo viene trasferito all’ossidrile presente sul C-2 del 3-fosfoglicerato a dare il 2,3-bisfosfoglicerato.
Nel secondo passaggio l’enzima opera come una fosfatasi convertendo il 2,3-bisfosfoglicerato in 2-fosfoglicerato; tuttavia il gruppo fosforico presente sul C-3 non viene rilasciato, ma si lega al residuo di istidina del sito attivo, a rigenerare l’intermedio enzima-His-fosfato.
Schematicamente:
Enzima-His-fosfato + 3-PG ⇄ Enzima-His + 2,3-BPG
Enzima-His + 2,3-BPG ⇄ Enzima-His-fosfato + 2-PG
Vale la pena notare che il gruppo fosforico del 2-fosfoglicerato prodotto non è lo stesso di quello originariamente presente nel 3-fosfoglicerato.[5]
| Fase | Dettagli |
|---|---|
| Reazione | 3-PG ⇄ 2-PG |
| Enzima | Fosfoglicerato mutasi |
| Cofattore | Mg2+; richiede 2,3-bisfosfoglicerato per l’attivazione |
| ΔG°′ | +4,4 kJ/mol (+1,1 kcal/mol) |
| ΔG | ≈ +0,8 kJ/mol (+0,2 kcal/mol) |
| Meccanismo | Avviene tramite un intermedio fosfoenzimatico e la formazione transitoria di 2,3-bisfosfoglicerato |
| Importanza | Riorganizza il gruppo fosforilico preparando la molecola per la formazione dell’intermedio ad alta energia fosfoenolpiruvato |
2,3-BPG e lo shunt di Rapoport-Luebering
All’incirca una volta ogni 100 passaggi catalitici il 2,3-BPG si dissocia dal sito attivo dell’enzima, lasciandolo defosforilato e inattivo. L’enzima può essere riattivato dal una nuova molecola di 2,3-BPG, che quindi deve essere sempre presente in piccole quantità nel citosol per mantenere l’attività ottimale. Il 2,3-bisfosfoglicerato è in effetti presente in piccole quantità nella maggior parte delle cellule, con l’eccezione dei globuli rossi, dove è prodotto attraverso lo shunt di Rapoport−Luebering. Nel globuli rossi agisce anche come inibitore allosterico dell’emoglobina, riducendone l’affinità per l’ossigeno.[23][24]
Nota: il 3-fosfoglicerato, oltre che proseguire nella via glicolitica, può essere utilizzato anche per la sintesi della serina, da cui derivano glicina e cisteina.
La sintesi della serina ha inizio con la reazione catalizzata dalla fosfoglicerato deidrogenasi (EC 1.1.1.95), in cui si verifica l’ossidazione del 3-fosfoglicerato a 3-fosfoidrossipiruvato e la concomitante riduzione del NAD+ a NADH. Questa reazione costituisce anche il passaggio limitante dell’intera via biosintetica, in quanto la serina inibisce l’attività della deidrogenasi.[25]
Reazione 9
Nella nona tappa della via glicolitica si verifica la deidratazione del 2-PG a dare fosfoenolpiruvato, un enolo. La reazione, reversibile, è catalizzata dalla enolasi (EC 4.2.1.11).
2-PG ⇄ PEP + H2O
La reazione richiede la presenza di Mg2+ che va a stabilizzare l’intermedio enolico che si forma nel corso del processo.[11]
Il ΔG°’ della reazione è pari a +1,8 kcal/mol (+7,5 kJ/mol), mentre il ΔG è pari a circa −0,8 kcal/mol (−3,3 kJ/mol), indicando che la reazione procede facilmente in vivo.[17]
Potenziale di trasferimento del gruppo fosforico e tautomeria
Come anticipato fosfoenolpiruvato e 1,3-bisfosfoglicerato sono gli unici due intermedi della glicolisi a possedere un potenziale di trasferimento del gruppo fosforico molto alto, sufficiente a permettere la sintesi dell’ATP.
Ma perché l’energia libera standard d’idrolisi del gruppo fosforico del PEP è così alta?
Sebbene PEP e 2-PG contengano all’incirca la stessa quantità totale di energia, rispetto alla completa ossidazione a CO2 e H2O e Pi, la deidratazione del 2-PG porta a una diversa ridistribuzione della stessa energia, tale che l’energia libera standard d’idrolisi dei due gruppi fosforici sia molto differente:
- −4,2 kcal/mol (−17,6 kJ/mol) per il 2-fosfoglicerato, un estere fosforico;
- −14,8 kcal/mol (−61,9 kJ/mol) per il fosfoenolpiruvato, un enol fosfato.
Quello che accade è che il gruppo fosforico del fosfoenolpiruvato intrappola la molecola nella sua forma enolica instabile. Quando, nell’ultima reazione della glicolisi, il PEP cede il gruppo fosforico all’ADP, si formano ATP e la forma enolica del piruvato. Quest’ultima è instabile e spontaneamente (o non enzimaticamente) tautomerizza nella più stabile forma chetonica, prevalente a pH fisiologico. Quindi, alla base dell’elevato potenziale di trasferimento del gruppo fosforico del fosfoenolpiruvato c’è la successiva tautomerizzazione enolo-chetone del piruvato, che fornisce una forte forza motrice termodinamica.[5][26]
| Fase | Dettagli |
|---|---|
| Reazione | 2-PG ⇄ PEP + H2O |
| Enzima | Enolasi |
| Cofattore | Mg2+ (stabilizza l’intermedio enolico) |
| ΔG°′ | +7,5 kJ/mol (+1,8 kcal/mol) |
| ΔG | ≈ –3,3 kJ/mol (–0,8 kcal/mol) |
| Potenziale di trasferimento del gruppo fosforico | PEP: –61,9 kJ/mol (–14,8 kcal/mol) vs 2-PG: –17,6 kJ/mol (–4,2 kcal/mol) |
| Importanza | Il PEP immagazzina energia in una forma enolica instabile; la tautomerizzazione del piruvato (da enolo a chetone) determina l’elevato potenziale di trasferimento del gruppo fosforico |
Reazione 10
Nell’ultimo passaggio della via glicolitica si verifica il trasferimento del gruppo fosforico dal PEP all’ADP con produzione di una molecola di ATP e una di piruvato.
PEP + ADP → Piruvato + ATP
La reazione, la seconda fosforilazione a livello del substrato della glicolisi, è catalizzata dalla piruvato chinasi, enzima tetramerico la cui attività, al pari della PFK-1, è altamente regolata. L’enzima possiede siti di legame per numerosi effettori allosterici. Inoltre, nei vertebrati, sono presenti tre forme isoenzimatiche, di cui una prevalente nel fegato, indicata come forma L, e un’altra, detta forma M, prevalente nel muscolo e nel cervello. Sebbene i diversi isoenzimi abbiano molte proprietà in comune, differiscono, oltre che nella distribuzione tissutale, anche nella risposta a ormoni quali glucagone, epinefrina e insulina.
L’attività dell’enzima è stimolata dallo ione potassio (K+), e da altri cationi monovalenti.[1][11][27]
La reazione è essenzialmente irreversibile, con un ΔG°’ pari a −7,5 kcal/mol (−31,4 kJ/mol), e un ΔG pari a circa −4,0 kcal/mol (−16,7 kJ/mol). L’irreversibilità è in gran parte dovuta, come anticipato nel paragrafo precedente, alla tautomerizzazione spontanea del piruvato dalla forma enolica instabile a quella chetonica stabile.[5]
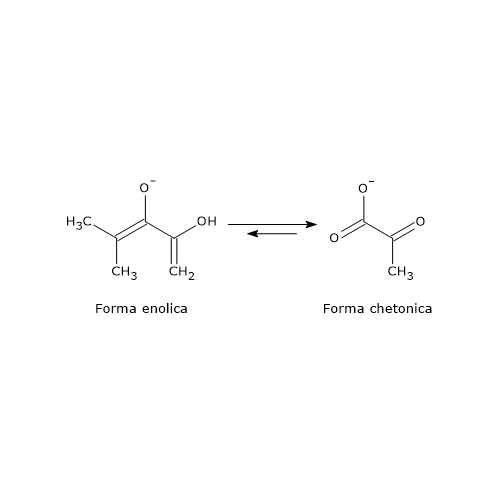
L’elevato potenziale energetico del PEP rende questa tappa una delle più decisive dell’intera via.
Energetica e irreversibilità
Delle −14,8 kcal/mol (−61,9 kJ/mol) derivanti dall’idrolisi dell’enol fosfato del fosfoenolpiruvato, circa la metà viene conservata grazie alla formazione del legame fosfoanidridico tra Pi e ADP, il cui ΔG°’ d’idrolisi è pari a −7,3 kcal/mol (−30,5 kJ/mol). La restante energia (−7,5 kcal/mol, −31,4 kJ/mol) agisce come forza trainante che spinge la reazione verso la produzione di ATP.[17]
Se, con la reazione catalizzata dalla fosfoglicerato chinasi (reazione 7) venivano pareggiate le due molecole di ATP spese nella fase preparatoria, con la reazione catalizzata dalla piruvato chinasi si ha un guadagno netto di due molecole di ATP per molecola di glucosio.
Destino di NADH e piruvato
I prodotti della glicolisi sono tre: due molecole di ATP, due di piruvato e due di NADH per molecola di glucosio.[1]
Perché la glicolisi possa procedere, è necessario che NADH sia riossidato a NAD+. Questo coenzima derivante dalla vitamina B3 (niacina), è presente nel citosol in concentrazione ≤ 10−5M, valore ben inferiore a quello del glucosio metabolizzato in pochi minuti, e deve essere quindi continuamente rigenerato. Il passaggio finale della via glicolitica è proprio la sua rigenerazione del NAD+ dal NADH attraverso vie metaboliche aerobiche o anaerobiche, ognuna delle quali comporta un ulteriore metabolismo del piruvato. Queste vie sono essenziali per il mantenimento del bilancio redox della cellula.[28]
Il piruvato è una molecola assai versatile che può entrare in diverse vie metaboliche, sia anaboliche che cataboliche, a seconda del tipo di cellula, dello stato energetico della cellula e della disponibilità di ossigeno.[29]
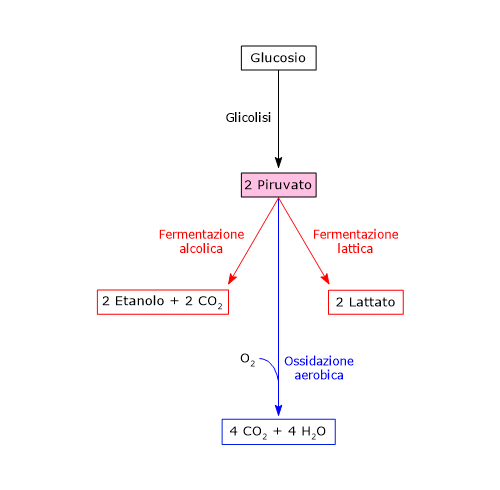
Con l’esclusione di alcune vie fermentative secondarie che si incontrano nel mondo dei batteri, sfruttate anche dall’industria alimentare per la produzione di vari alimenti tra cui molti formaggi, sono essenzialmente tre le vie cataboliche che possono essere imboccate dal piruvato:
- la riduzione ad acido lattico, attraverso la fermentazione lattica;
- la riduzione a etanolo, attraverso la fermentazione alcolica;
- l’ossidazione aerobica.
Questo permette alla glicolisi di procedere sia in condizioni anaerobiche che aerobiche. È quindi anche possibile affermare, ampliando la visuale, che il destino catabolico dello scheletro carbonioso del glucosio è influenzato dal tipo di cellula, dal suo stato energetico e dalla disponibilità di ossigeno.[11]
Fermentazione lattica
Negli animali, con poche eccezioni, e in molti microrganismi, quando la disponibilità di ossigeno non è sufficiente a soddisfare le richieste energetiche della cellula, o se la cellula è priva di mitocondri, il piruvato prodotto dalla glicolisi viene ridotto a lattato nella reazione catalizzata dalla lattato deidrogenasi (EC 1.1.1.27).[11]
Piruvato + NADH + H+ ⇄ Lattato + NAD+
Nella reazione il NADH fornisce gli equivalenti riducenti e si ossida a NAD+. L’equilibrio della reazione favorisce fortemente la formazione del lattato, come testimoniato dal ΔG°’ pari a −6 kcal/mol (−25,1 kJ/mol).[30]
L’equazione complessiva della conversione del glucosio lattato, definita fermentazione lattica, è:
Glucosio + 2 Pi + 2 ADP → 2 Lattato + 2 ATP + 2 H2O
Scoperta da Louis Pasteur, che la definì “la vie sans l’air”, la fermentazione è un processo che:
- estrae energia dal glucosio, immagazzinandola in forma di ATP;
- non consuma ossigeno;
- non modifica il rapporto NAD+/NADH.[31]
Sebbene ne NAD+ ne NADH compaiano nella reazione complessiva, sono entrambe intermedi essenziali. Quindi non si verifica alcuna ossidazione o riduzione netta. In altri termini, nel passaggio da glucosio C6H12O6, a lattato, C3H6O3, il rapporto H:C non varia.[1]
Tuttavia, dal punto di vista energetico va sottolineato che la fermentazione permette di estrarre una piccola quantità dell’energia chimica totale contenuta nella molecola del glucosio.
Destino dell’acido lattico
Nell’uomo molto del lattato prodotto entra nel ciclo di Cori, per essere riutilizzato nella gluconeogenesi epatica. In definitiva si può anche affermare che la produzione di lattato sposta parte del carico metabolico dai tessuti extraepatici, ad esempio il muscolo scheletrico nel corso di un esercizio intenso (come uno sprint, quando la velocità della glicolisi può quasi istantaneamente aumentare anche di 2000 volte), al fegato.[32]
A differenza del muscolo scheletrico che rilascia il lattato nel circolo ematico, il muscolo cardiaco è in grado di assumere lattato e utilizzarlo come carburante per produrre ATP. Questo è possibile grazie alle proprietà dell’isoenzima cardiaco della lattato deidrogenasi, LDH-4, e al suo metabolismo completamente aerobico. Quindi, parte del lattato rilasciato dal muscolo scheletrico sottoposto a un lavoro intenso sarà utilizzato dal muscolo cardiaco come carburante.[33]
Nota: il lattato prodotto dai microorganismi durante la fermentazione lattica è responsabile sia del profumo che del gusto dei crauti, ossia dei cavoli fermentati, come anche del gusto del latte acido.[34]
Fermentazione alcolica
In microorganismi come il lievito di birra e il lievito da panificazione, in certi tessuti vegetali, e in alcuni invertebrati e protisti, il piruvato, in condizioni ipossiche o anaerobiche, può essere ridotto in due passaggi a etanolo, con liberazione di CO2. Questo si verifica in due passaggi enzimatici.[32]
Il primo passaggio comporta la decarbossilazione non ossidativa del piruvato a dare acetaldeide. La reazione, essenzialmente irreversibile, è catalizzata dalla piruvato decarbossilasi (EC 4.1.1.1), che richiede la presenza di Mg2+ e tiamina pirofosfato, un coenzima derivante dalla vitamina B1 (tiamina). La piruvato decarbossilasi è assente nei tessuti dei vertebrati e negli altri organismi che operano la fermentazione lattica.
Nel secondo passaggio si verifica la riduzione dell’acetaldeide a etanolo nella reazione catalizzata dalla alcol deidrogenasi (EC 1.1.1.1), enzima che ha un atomo di zinco legato nel sito attivo. Nella reazione il NADH fornisce gli equivalenti riducenti e si ossida a NAD+. A pH fisiologico, l’equilibrio della reazione è fortemente spostato verso la formazione di etanolo.
La processo complessivo, definita fermentazione alcolica, è riassunta dall’equazione:
Glucosio + 2 Pi + 2 ADP → 2 Etanolo + 2 CO2 + 2 ATP + 2 H2O
Al pari della fermentazione lattica, anche nella fermentazione alcolica non si verifica alcuna ossido-riduzione netta.[35]
La fermentazione alcolica è alla base della produzione della birra e del vino. Da notare che la CO2 prodotta dal lievito di birra è responsabile delle caratteristiche bollicine della birra, dello champagne e dello spumante, mentre la CO2 prodotta dal lievito usato nella panificazione porta alla lievitazione dell’impasto.[36]
Destino del piruvato e NADH in condizioni aerobiche
Nelle cellule con mitocondri e in condizioni aerobiche, la situazione più comune negli organismi multicellulari e in molti unicellulari, l’ossidazione del NADH e il catabolismo del piruvato seguono vie distinte ma interconnesse.
All’interno dei mitocondri, il piruvato viene convertito in acetil-CoA nelle reazioni catalizzate dal complesso della piruvato deidrogenasi, uno dei complessi multienzimatici mitocondriali. Nella reazione complessiva, una decarbossilazione ossidativa, il piruvato perde un atomo di carbonio in forma di CO2, e l’unità a due atomi di carbonio rimanente è legata al coenzima A a dare acetil-coenzima A o semplicemente acetil-CoA.[37][38]
Piruvato + NAD+ + CoA → Acetil-CoA + CO2 + NADH + H+
Il gruppo acetilico dell’acetil-CoA è quindi completamente ossidato a CO2 attraverso le reazioni del ciclo dell’acido citrico, con produzione di ulteriore NADH, e anche di FADH2. Il complesso della piruvato deidrogenasi rappresenta quindi un ponte tra la glicolisi, una via citosolica, e il ciclo dell’acido citrico, una via mitocondriale.[32]
Gli elettroni generati durante la glicolisi vengono trasferiti indirettamente nei mitocondri: il NADH citosolico riduce specifici intermedi navetta, che vengono poi riossidati all’interno della matrice mitocondriale. In questo modo nel citosol viene rigenerato NAD+ dal NADH, mentre l’intermedio ridotto, una volta nella matrice mitocondriale, è riossidato grazie al trasferimento dei suoi equivalenti riducenti al Complesso I della catena di trasporto degli elettroni. Da lì, gli elettroni vengono trasferiti attraverso la catena all’ossigeno, producendo H2O. Questo trasferimento fornisce l’energia libera necessaria per la sintesi di ATP tramite fosforilazione ossidativa.
Ovviamente anche gli elettroni trasportati dal NADH prodotto nelle reazioni catalizzate dal complesso della piruvato deidrogenasi e nel ciclo dell’acido citrico, e quelli del FADH2, seguono un analogo destino.[39]
Nota: il FADH2 cede i suoi equivalenti riducenti non al Complesso I ma al Complesso II.[40]
Destini anabolici del piruvato
In condizioni anaboliche, lo scheletro carbonioso del piruvato può avere destini diversi dalla completa ossidazione a CO2, o dalla conversione in lattato. Infatti, previa conversione in acetil-CoA, potrà essere utilizzato ad esempio per la sintesi degli acidi grassi, o dell’aminoacido alanina.[41][42]
Glicolisi e produzione di ATP
Nella via glicolitica una molecola di glucosio viene convertita in due di piruvato.
- Durante la fase preparatoria, sono consumate due molecole di ATP nelle reazioni catalizzate dalla esochinasi e dalla PFK-1.
- Nella fase di recupero energetico, sono prodotte quattro molecole di ATP attraverso fosforilazioni a livello del substrato nelle reazioni catalizzate dalla fosfoglicerato chinasi e dalla piruvato chinasi.
Quindi si ha un guadagno netto di due molecole di ATP per molecola di glucosio. In aggiunta, la reazione catalizzata dalla gliceraldeide-3-fosfato deidrogenasi produce due molecole di NADH per molecola di glucosio.
Il ΔG°’ dell’intero processo è pari a −20,3 kcal/mol (−85 kJ/mol). Questo valore deriva dalla differenza tra:
- il ΔG°’ della conversione del glucosio in due molecole di piruvato (−34,9 kcal/mol, −146 kJ/mol);
- il ΔG°’ della formazione dell’ATP da ADP e Pi, pari a 2 x 7,3 kcal/mol = +14,6 kcal/mol (2 x 30,5 kJ/mol = +61 kJ/mol).
Di seguito le due reazioni.
Glucosio + 2 NAD+ → 2 Piruvato + 2 NADH + 2 H+
2 ADP + 2 Pi → 2 ATP + 2 H2O
La somma delle due reazioni da la reazione glicolitica complessiva:
Glucosio + 2 NAD+ + 2 ADP + 2 Pi → 2 Piruvato + 2 NADH + 2 H+ + 2 ATP + 2 H2O
Dunque, in condizioni standard, la frazione di energia rilasciata che viene immagazzinata nell’ATP corrisponde a:
(14,6/34,9) x 100 = 41,8%.
In alternativa, l’equazione complessiva della glicolisi può anche essere derivata considerando tutti i reagenti in ingresso e i prodotti.
Glucosio + 2 ATP + 2 NAD+ + 4 ADP + 2 Pi → 2 Piruvato + 2 ADP + 2 NADH + 2 H+ + 4 ATP + 2 H2O
Eliminando i termini comuni a entrambe i lati si ottiene l’equazione complessiva mostrata sopra.[17]
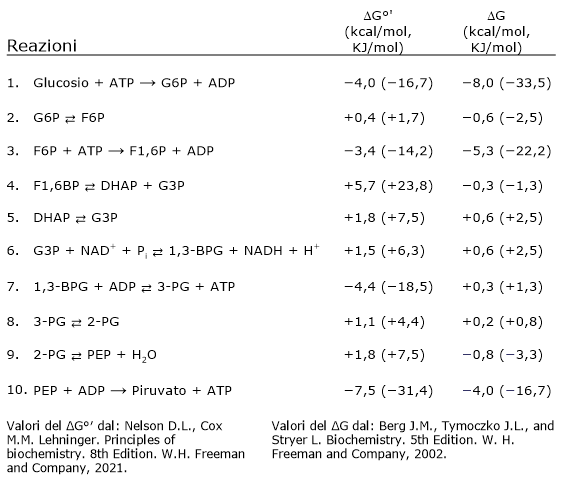
Variazioni di energia libera delle reazioni glicolitiche
La direzione e la regolazione della glicolisi dipendono dalle variazioni di energia libera dei singoli passaggi. La tabella seguente riassume i valori di ΔG standard e cellulari per ciascuna reazione, mostrando che, in condizioni fisiologiche, solo poche tappe sono fortemente esoergoniche ed essenzialmente irreversibili.[17]
Di seguito è riportata anche una rappresentazione grafica.
| Fase | Reazione | ΔG°′ (kcal/mol, kJ/mol) |
ΔG (kcal/mol, kJ/mol, ) |
|---|---|---|---|
| 1 | Glu + ATP → G6P + ADP | –4,0 (–16,7) | –33,5 (–8,0) |
| 2 | G6P ⇄ F6P | +0,4 (+1,7) | –0,6 (–2,5) |
| 3 | F6P + ATP → F1,6BP + ADP | –3,4 (–14,2) | –5,3 (–22,2) |
| 4 | F1,6P ⇄ DHAP + G3P | +5,7 (+23,8) | –0,3 (–1,3) |
| 5 | DHAP ⇄ G3P | +1,8 (+7,5) | +0,6 (+2,5) |
| 6 | G3P + NAD+ + Pi ⇄ 1,3-BPG + NADH + H+ | +1,5 (+6,3) | +0,6 (+2,5) |
| 7 | 1,3-BPG + ADP ⇄ 3-PG + ATP | –4,4 (–18,5) | +0,3 (+1,3) |
| 8 | 3-PG ⇄ 2-PG | +1,1 (+4,4) | +0,2 (+0,8) |
| 9 | 2-PG ⇄ PEP + H2O | +1,8 (+7,5) | –0,8 (–3,3) |
| 10 | PEP + ADP → Piruvato + ATP | –7,5 (–31,4) | –4,0 (–16,7) |
| Valori di ΔG°′ da: Nelson D.L., Cox M.M. Lehninger. Principles of Biochemistry. 8ª edizione. W.H. Freeman and Company, 2021. | Valori di ΔG da: Berg J.M., Tymoczko J.L., Gregory J.G. Jr, Stryer L. Biochemistry. 9ª edizione. W.H. Freeman and Company, 2019. | ||
Produzione di ATP in condizioni anaerobiche
In condizioni anaerobiche, a prescindere da quello che sarà il destino metabolico del piruvato, conversione in lattato, etanolo o altre molecole, non sono prodotte altre molecole di ATP a valle della glicolisi.[43]
Quindi, in queste condizioni, la glicolisi estrae solamente una piccola frazione dell’energia chimica contenuta nella molecola del glucosio, che è pari a +679 kcal/mol (+2840 kJ/mol) ed è rilasciata a seguito della sua completa ossidazione a CO2 e H2O. Di contro, la conversione del glucosio in due molecole di piruvato porta al rilascio di sole 34,9 kcal/mol (146 kJ/mol), il che significa che solamente circa il 5%, [(34,9/679) x 100], dell’energia chimica disponibile. Quindi il piruvato contiene ancora la maggior parte dell’energia chimica del glucosio.
Analogamente, in condizioni anaerobiche, neppure i quattro elettroni trasportati dalle due molecole di NADH potranno essere utilizzati per la produzione di ATP.[17]
Considerando la fermentazione lattica, il ΔG°’ associato alla conversione di una molecola di glucosio in due di lattato è pari a −43,9 kcal/mol (−183,6 kJ/mol), e la percentuale dell’energia libera immagazzinata in forma di ATP sarà pari a circa il 33,2% [(14,6/43,9) x 100]. Questo è un valore inferiore all’efficienza di accumulo dell’energia osservata nella conversione del glucosio in piruvato, pari a circa il 41,8%.[44]
Da notare che, nelle condizioni intracellulari, la quantità di energia libera necessaria per la sintesi dell’ATP da ADP e Pi è molto più elevata di quella in condizioni standard, per cui, in vivo, la percentuale dell’energia libera disponibile immagazzinata è maggiore, pari a circa il 50% del totale.[1]
Produzione di ATP in condizioni aerobiche
In condizioni aerobiche, nelle cellule dotate di mitocondri, la quantità di energia chimica che può essere estratta dalla molecola del glucosio e immagazzinata in forma di ATP è molto maggiore che in condizioni anaerobiche.[14]
Considerando le due molecole di NADH prodotte durante la glicolisi, il trasferimento dei loro 4 equivalenti riducenti lungo la catena di trasporto degli elettroni mitocondriale permette la produzione di 2−3 molecole di ATP per coppia di elettroni attraverso la fosforilazione ossidativa. Si avrà quindi una produzione di 6 e 8 molecole di ATP per ogni molecola di glucosio ossidata: due ATP attraverso la fosforilazione a livello del substrato e da 4 a 6 dalla fosforilazione ossidativa.[40]
Nota: il numero esatto di molecole di ATP prodotte a partire dal NADH citosolico dipende dal sistema navetta attraverso cui gli equivalenti riducenti entrano nel mitocondrio.
Se invece si analizza la completa ossidazione aerobica del glucosio a mezzo dell’azione coordinata della glicolisi, del complesso della piruvato deidrogenasi, del ciclo dell’acido citrico, della catena di trasporto degli elettroni mitocondriale e della fosforilazione ossidativa, viene immagazzinata in forma di ATP molta altra dell’energia chimica disponibile presente nel monosaccaride. In questo caso, secondo quanto riportato dal Lehninger’s Principles of Biochemistry, sono prodotti 30−32 ATP/molecola di glucosio, sebbene recenti stime suggeriscano una produzione netta pari a 29,85 ATP/molecola di glucosio, o 29,38 ATP/molecola di glucosio se anche l’ATP derivato dal GTP, prodotto dal ciclo dell’acido citrico, viene esportato. Considerando entrambe le stime, la produzione di ATP è circa 15 volte maggiore rispetto a quanto accade in assenza di ossigeno.[1]
Vie di alimentazione della glicolisi
Oltre al glucosio, altri carboidrati, sia semplici che complessi, possono essere catabolizzati attraverso la glicolisi, previa conversione enzimatica in uno degli intermedi della via metabolica.
Tra i più importanti si ritrovano:
- due polisaccaridi di deposito, il glicogeno e l’amido;
- diversi disaccaridi quali saccarosio, maltosio, lattosio e trealosio;
- i monosaccaridi quali glucosio, galattosio, fruttosio e il meno comune mannosio.[45]
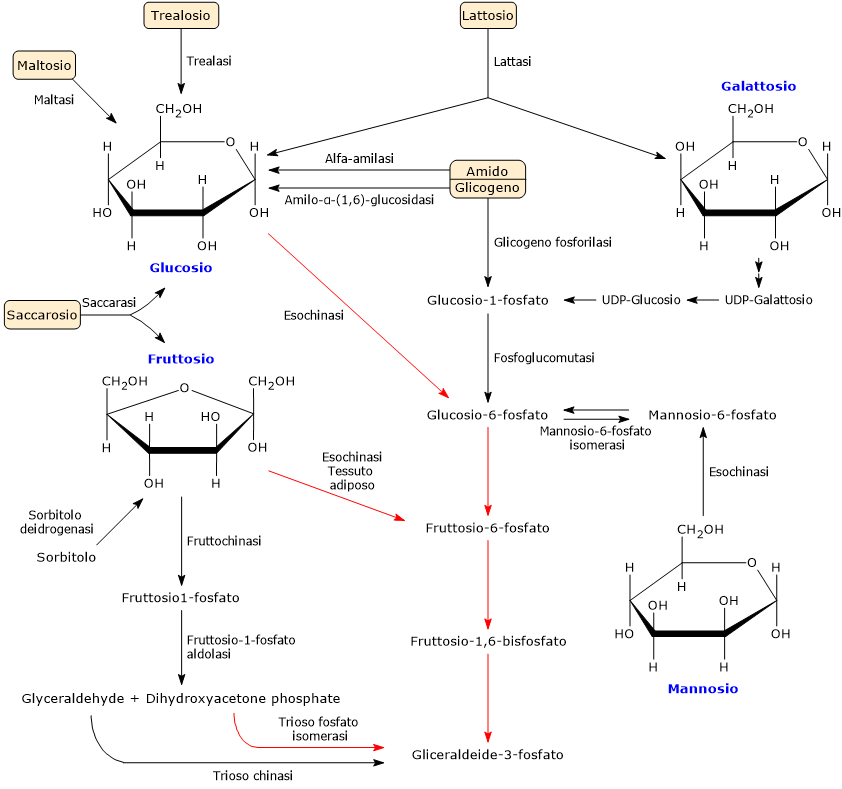
Nell’intestino, amido e disaccaridi assunti con l’alimentazione incontrano gli enzimi responsabili della digestione dei carboidrati. Segue l’assorbimento dei monosaccaridi liberati e derivanti dall’alimentazione. Una volta nel circolo venoso, i monosaccaridi raggiungono, attraverso la vena porta, il fegato, la sede principale del loro metabolismo.[46]
Glicogeno e amido
Per quanto riguarda il catabolismo fosforolitico dell’amido e del glicogeno endogeno si rimanda ai rispettivi articoli.
Fruttosio
In condizioni fisiologiche, il fegato rimuove dal circolo ematico molto del fruttosio ingerito, prima che lo stesso possa raggiungere i tessuti extraepatici.[47]
La via metabolica che porta alla conversione del monosaccaride in intermedi della glicolisi si compone di alcuni passaggi.[32]
Nel primo, il fruttosio viene fosforilato a fruttosio-1-fosfato nella reazione catalizzata dalla fruttochinasi (EC 2.7.1.4), con consumo di una molecola di ATP.
Fruttosio + ATP → Fruttosio-1-fosfato + ADP
La reazione richiede la presenza di Mg2+.
Come per il glucosio, anche per il fruttosio la fosforilazione ha come effetto quello di intrappolare la molecola all’interno della cellula.
Nel secondo passaggio il fruttosio-1-fosfato viene scisso a diidrossiacetone fosfato e gliceraldeide, nella reazione catalizzata dalla fruttosio-1-fosfato aldolasi.
F1P→ DHAP + Gliceraldeide
Il diidrossiacetone fosfato è un intermedio della glicolisi e prosegue lungo la via previa isomerizzazione a gliceraldeide-3-fosfato. Invece, la gliceraldeide, che non è un intermedio glicolitico, viene fosforilata a gliceraldeide-3-fosfato nella reazione catalizzata dalla trioso chinasi (EC 2.7.1.28), con consumo di una seconda molecola di ATP.
Gliceraldeide + ATP → G3P + ADP
La reazione richiede la presenza di ioni Mg2+.
Quindi, nell’epatocita, una molecola di fruttosio viene convertita in due di gliceraldeide-3-fosfato, con consumo di due molecole di ATP, come per il glucosio.[48]
Fruttosio + 2 ATP → 2 G3P +2 ADP
Fruttosio ed esochinasi
In sedi extraepatiche come il muscolo scheletrico, il rene o il tessuto adiposo non è presente la fruttochinasi, e il fruttosio entra nella via glicolitica in forma di fruttosio-6-fosfato. Infatti, tra i substrati della esochinasi c’è anche il fruttosio, che viene fosforilato in posizione C-6.
Fruttosio + ATP → F6P + ADP
L’affinità dell’enzima per il fruttosio è però circa 20 volte minore rispetto a quella per il glucosio, per cui nell’epatocita, dove il glucosio è molto più abbondante del fruttosio, o nel muscolo scheletrico in condizioni di scarsa disponibilità di ossigeno, quando cioè il glucosio diviene il carburante preferito, si forma poco fruttosio-6-fosfato.[11][47]
Al contrario, nel tessuto adiposo, il fruttosio può essere più abbondante del glucosio, per cui la sua fosforilazione a opera della esochinasi non è inibita competitivamente in modo significativo dal glucosio stesso. Ne consegue che, in questo tessuto, la sintesi del fruttosio-6-fosfato rappresenta il principale punto di ingresso del monosaccaride nella glicolisi.[49]
Implicazioni metaboliche
Ai fini degli effetti metabolici del fruttosio è importante sottolineare che nel fegato il monosaccaride, essendo fosforilato in posizione C-1, entra nella glicolisi a livello dei trioso fosfati, dunque a valle della reazione catalizzata dalla PFK-1, enzima che gioca un ruolo chiave nella regolazione del flusso del carbonio attraverso la glicolisi stessa. Al contrario, quando il monosaccaride viene fosforilato sul C-6, entra nella via glicolitica a monte della reazione catalizzata dalla PFK-1.[9]
Sorbitolo
Il fruttosio rappresenta il punto d’ingresso nella via glicolitica per il sorbitolo. Lo zucchero è presente in molti frutti e vegetali, e viene utilizzato anche come dolcificante e stabilizzante.
Nel fegato il sorbitolo è convertito in fruttosio nella reazione catalizzata dall’enzima citosolico sorbitolo deidrogenasi (EC 1.1.1.14). La reazione richiede ioni zinco e il NAD+ come cofattore.[32] L’enzima partecipa anche alla via dei polioli, che interconverte glucosio, sorbitolo e fruttosio, svolge un ruolo importante in tessuti come il fegato, le vescicole seminali e la retina.[48]
Sorbitolo + NAD+ → Fruttosio + NADH + H+
Galattosio
Il galattosio, che per la maggior parte deriva dalla digestione intestinale del lattosio, raggiunto il fegato viene convertito, attraverso la via di Leloir, in glucosio-1-fosfato.[50]
Il destino del glucosio-1-fosfato dipende dallo stato energetico della cellula.
- In condizioni che favoriscono il deposito di glucosio, G1P può essere incanalato nella via di sintesi del glicogeno.
- In condizioni che favoriscono l’utilizzo del glucosio per la produzione di energia, il G1P viene isomerizzato in glucosio-6-fosfato nella reazione reversibile catalizzata dalla fosfoglucomutasi (EC 5.4.2.2).
G1P ⇄ G6P
A sua volta il glucosio-6-fosfato prodotto potrà entrare nella via glicolitica per essere utilizzato per la produzione di energia, o essere defosforilato a glucosio nella reazione catalizzata dalla glucosio-6-fosfatasi (EC 3.1.3.9) ed essere quindi rilasciato nel circolo ematico.[51][52]
Mannosio
Il mannosio è presente in vari polisaccaridi, glicolipidi e glicoproteine della dieta. Nell’intestino, una volta liberato da queste macromolecole, viene assorbito, e, raggiunto il fegato, è fosforilato in posizione C-6 a dare mannosio-6-fosfato (M6P), nella reazione catalizzata dalla esochinasi.
Mannosio + ATP → M6P + ADP
Il mannosio-6-fosfato è quindi isomerizzato a fruttosio-6-fosfato nella reazione catalizzata dalla mannosio-6-fosfato isomerasi (EC 5.3.1.8).[53]
M6P ⇄ F6P
Regolazione della glicolisi
Il flusso di carbonio attraverso la glicolisi è finemente regolato in base alle condizioni metaboliche, sia intra- che extracellulari, al fine di rispondere a due bisogni principali:
- la produzione di ATP;
- la produzione di precursori per molte vie biosintetiche.
Nel fegato, per evitare uno spreco di energia, glicolisi e gluconeogenesi sono reciprocamente regolate in modo che quando una via procede l’altra rallenta. Nel corso dell’evoluzione questo controllo è stato ottenuto selezionando enzimi differenti per catalizzare le reazioni essenzialmente irreversibili delle due vie, enzimi la cui attività è regolata separatamente. Se infatti queste reazioni procedessero simultaneamente a elevata velocità creerebbero un ciclo futile o ciclo del substrato. Una regolazione così fine non potrebbe essere ottenuta se uno stesso enzima catalizzasse la reazione nelle due direzioni.[7]
Il controllo della glicolisi coinvolge principalmente tre enzimi: esochinasi, PFK-1 e piruvato chinasi. Le loro attività sono regolate mediante:
- meccanismi allosterici, che si verificano in una scala temporale di millisecondi e sono rapidamente reversibili;
- modificazioni covalenti, ossia fosforilazioni e defosforilazioni, che si verificano in una scala temporale di secondi;
- modificazioni nella concentrazione degli enzimi, conseguenti a modifiche nella loro velocità di sintesi/degradazione, che avvengono in ore.
Nota: per la gluconeogenesi i principali punti di regolazione sono gli enzimi piruvato carbossilasi (EC 6.4.1.1) e fruttosio-1,6-bisfosfatasi (EC 3.1.3.11).[1][11]
Esochinasi
Nell’uomo la esochinasi è presente con quattro forme isoenzimatiche tessuto specifiche, designate da I a IV, e codificate da altrettanti geni differenti.[16]
La esochinasi I è l’isoenzima prevalente nel cervello, mentre nel muscolo scheletrico si ritrova sia l’esochinasi I, che costituisce il 70-75% dell’attività esochinasica totale, che la esochinasi II, che rappresenta il restante 25-30%.[9]
L’esochinasi IV, detta anche glucochinasi (EC 2.7.1.2) è presente prevalentemente negli epatociti e nelle cellule β del pancreas, dove è l’isoenzima prevalente. Nel fegato, con la glucosio-6-fosfatasi, catalizza il ciclo del substrato tra glucosio e glucosio-6-fosfato.
La glucochinasi differisce dalle altre isoforme della esochinasi per quanto riguarda la cinetica e le proprietà regolatorie.[54]
Nota: gli isoenzimi o isozimi sono proteine differenti che catalizzano la stessa reazione, ma che, in genere, si differenziano per le proprietà cinetiche e regolatorie, distribuzione subcellulare, o per i cofattori utilizzati. Possono essere presenti contemporaneamente in una stessa specie, tessuto o anche cellula.[55]
Proprietà cinetiche delle esochinasi
Le esochinasi I, II e III hanno proprietà cinetiche simili.
- Le esochinasi I e la II hanno una Km per il glucosio rispettivamente pari a 0,03 mM e 0,1 mM. Pertanto questi due isoenzimi lavorano in modo molto efficiente ai normali valori di glicemia, che sono pari a circa 4-5 mM.[7]
- Invece la glucochinasi ha una Km per il glucosio assai più alta, pari a circa 10 mM. Ciò significa che l’attività dell’enzima diviene importante solo quando i valori della glicemia sono alti, come dopo un pasto ricco di carboidrati.[9]
Regolazione delle esochinasi I-III
Le esochinasi I-III sono inibite allostericamente dal glucosio-6-fosfato, il prodotto della loro reazione.[16] Questo assicura che il glucosio-6-fosfato non si accumuli nella cellula quando non è richiesto ulteriore glucosio per:
- la produzione di ATP;
- la sintesi del glicogeno;
- la via del pentoso fosfato;
- come fonte di intermedi per la sintesi di altre molecole.[5]
Allo stesso tempo permette di ridurre l’assunzione dal circolo di altro glucosio che rimane quindi disponibile per altri organi e tessuti. Ad esempio, quando la PFK-1 è inibita, si accumula fruttosio-6-fosfato e, grazie alla reazione catalizzata dalla fosfoglucosio isomerasi, glucosio-6-fosfato. Dunque, l’inibizione della PFK-1 porta alla inibizione delle esochinasi I-III.[56]
Coordinazione di esochinasi e GLUT4 nel muscolo scheletrico
Nel muscolo scheletrico l’attività della esochinasi I e II è strettamente coordinata con quella di GLUT4, un trasportatore del glucosio con una bassa Km per il monosaccaride (≈ 5 mM), la cui traslocazione sulla membrana plasmatica è indotta sia dall’insulina che dall’attività fisica. L’azione combinata delle esochinasi e di GLUT4 mantiene un equilibrio tra l’ingresso del glucosio nella cellula e la sua fosforilazione.[9]
Considerando che la concentrazione ematica del glucosio è compresa tra 4 e 5 mmol/L, il suo ingresso nella cellula muscolare per mezzo di GLUT4 può portare la sua concentrazione a valori sufficientemente elevati da saturare o quasi l’esochinasi, che dunque può lavora vicino o addirittura alla sua Vmax.[57]
Glucochinasi epatica
La glucochinasi differisce per almeno tre aspetti dalle esochinasi I-III ed è particolarmente idonea per il ruolo che il fegato svolge nella regolazione della glicemia.[54][58]
Proprietà cinetiche e funzionali
Come detto in precedenza, la glucochinasi ha una Km per il glucosio pari a circa 10 mM, molto più elevata rispetto a quella delle esochinasi I-III, e anche più alta del valore della glicemia a digiuno, pari a circa 4-5 mM. Nel fegato, dove la glucochinasi è l’isoenzima prevalente, il suo ruolo è quello di fornire glucosio-6-fosfato per la sintesi del glicogeno e degli acidi grassi. L’enzima lavora in modo coordinato con il trasportatore del glucosio GLUT2, il principale trasportatore per il glucosio nell’epatocita, la cui Km per lo zucchero è alta, circa 10 mM.[16]
Pertanto, GLUT2 è molto attivo quando la glicemia è elevata, equilibrando rapidamente la concentrazione del glucosio nel citosol dell’epatocita con quella presente nel sangue. In queste condizioni la glucochinasi è attiva e catalizza la conversione del glucosio in G6P, e, grazie alla elevata Km per il glucosio la sua attività continua ad aumentare anche quando la concentrazione intracellulare dello zucchero raggiunge o supera le 10 mM. Quindi, la velocità con cui il monosaccaride entra nella cellula e di seguito viene fosforilato è determinata dal valore della glicemia.[59]
Quando invece la disponibilità del glucosio è scarsa, la sua concentrazione nel citosol dell’epatocita è altrettanto bassa, ben più bassa del valore della Km della glucochinasi. In questa condizione il glucosio prodotto attraverso la gluconeogenesi e/o la glicogenolisi non viene fosforilato e può lasciare la cellula.[60] Una situazione simile si verifica anche nelle cellule β del pancreas, dove il sistema GLUT2/glucochinasi fa si che la concentrazione intracellulare del glucosio-6-fosfato equipari quella del glucosio nel sangue, permettendo alla cellula di rilevare e rispondere alle iperglicemie.[61]
Regolazione da parte di GKRP
A differenza delle esochinasi I-III, la glucochinasi non è inibita dal glucosio-6-fosfato, per cui continua a catalizzarne la sintesi anche quando questi si accumula. La glucochinasi viene inibita a seguito del legame reversibile a una specifica proteina regolatrice epatica, GKRP, acronimo dell’inglese glucokinase regulatory protein. Il meccanismo con cui GKRP agisce implica l’ancoraggio della glucochinasi all’interno del nucleo, dove rimane separata dagli altri enzimi della glicolisi.[60][62]
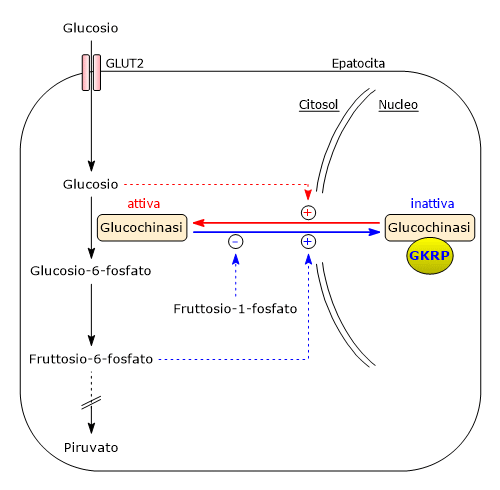
Il legame tra glucochinasi e GKRP è molto più forte in presenza del fruttosio-6-fosfato mentre è indebolito dal glucosio e dal fruttosio-1-fosfato.
In assenza di glucosio la glucochinasi si trova nella sua conformazione “super-aperta” che è in grado di legarsi alla GKRP. L’aumento nei livelli citosolici di glucosio determina una transizione concentrazione-dipendente dell’enzima verso la sua conformazione chiusa, la conformazione attiva, che non è accessibile alla GKRP. Ne consegue che la glucochinasi è attiva e non più inibita.
Da notare che il fruttosio-1-fosfato è presente nell’epatocita solamente quando viene metabolizzato il fruttosio. Ne consegue che il fruttosio, quando disponibile, fa venire meno l’inibizione della glucochinasi da parte di GKRP.[63]
Significato fisiologico
Quando dopo un pasto ricco di carboidrati la glicemia sale, il glucosio, tramite il GLUT2, entra nella cellula epatica, e quindi attraverso i pori nucleari diffonde nel nucleo dove promuove la transizione della glucochinasi verso la sua conformazione chiusa, attiva e non accessibile a GKRP. Ciò permette all’enzima di diffondere nel citosol dove potrà fosforilare il glucosio.
Viceversa, quando il glucosio è scarso, come nel digiuno quando la glicemia può scendere sotto il valore di 4 mM, la concentrazione del glucosio nell’epatocita è bassa. In queste condizioni il fruttosio-6-fosfato si associa a GKRP, aumentandone l’affinità per la glucochinasi e determinando una forte inibizione dell’enzima. Questo meccanismo concorre assicura che il fegato, in condizioni di bassa glicemia, non competa con gli altri organi, principalmente il cervello, per il poco glucosio disponibile.
Nella cellula il fruttosio-6-fosfato è presente in equilibrio con il glucosio-6-fosfato grazie alla reversibilità della reazione catalizzata dalla fosfoglucosio isomerasi. Tramite la sua associazione con GKRP, il fruttosio-6-fosfato opera quindi un feedback negativo segnalando alla cellula che non è necessario produrre altro glucosio-6-fosfato, ossia che l’attività della glucochinasi può ridursi per prevenire l’accumulo di intermedi.
Riassumendo, si può dire che quando i valori della glicemia sono normali, il glucosio viene fosforilato prevalentemente dalle esochinasi I-III, mentre quando la glicemia è elevata anche la glucochinasi contribuisce alla fosforilazione del glucosio.[9][64]
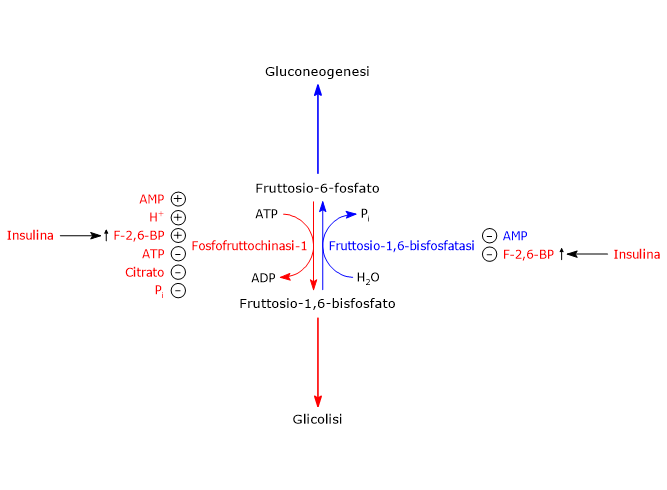
Regolazione della fosfofruttochinasi-1
La fosfofruttochinasi-1 è il punto di controllo chiave del flusso di carbonio attraverso la glicolisi.[65]
L’enzima, oltre ai siti di legame per i substrati, presenta molti altri siti su cui vanno a legarsi effettori allosterici.
Tra gli inibitori allosterici si ha l’ATP, che è anche un substrato dell’enzima e un prodotto finale della glicolisi, il citrato e gli ioni idrogeno, mentre AMP, Pi e il fruttosio-2,6-bisfosfato sono attivatori allosterici.[66][67][68]
Nota: la PFK-1 presenta due siti di legame distinti per l’ATP, uno nel sito attivo e dotato di grande affinità per la molecola, e l’altro, regolatorio, a bassa affinità.[9]
Cosa segnalano gli effettori allosterici
ATP, AMP e Pi segnalano lo stato energetico della cellula. L’attività di PFK-1 aumenta quando la cellula necessita di energia, ossia, quando c’è necessità di ATP, mentre si riduce quando la carica energetica della cellula è alta, ossia, quando la cellula è ricca di ATP.[69]
Come avviene questa regolazione
Quando l’ATP è prodotto più velocemente di quanto venga consumato, la sua concentrazione intracellulare aumenta. In queste condizioni, l’ATP si lega al suo sito allosterico e inibisce la PFK-1, riducendone l’affinità per il fruttosio-6-fosfato.
Dal punto di vista cinetico l’aumento della concentrazione dell’ATP determina un cambiamento della relazione tra la velocità di reazione e la concentrazione del fruttosio-6-fosfato, relazione che da iperbolica diviene sigmoide. Quindi si ha un aumento della Km dell’enzima per il substrato.
Tuttavia, nella maggior parte delle condizioni fisiologiche, la concentrazione intracellulare dell’ATP non varia significativamente. Ad esempio, nel muscolo durante un esercizio vigoroso, la concentrazione dell’ATP può ridursi di circa un 10% rispetto ai livelli di riposo, mentre la velocità della glicolisi varia molto di più rispetto a quanto ci si aspetterebbe da tale riduzione.
Quando la velocità di produzione dell’ATP è inferiore a quella con cui viene consumato, si verifica l’aumento della concentrazione dell’AMP e dell’ADP, e in particolare dell’AMP, grazie all’azione dell’enzima adenilato chinasi (EC 2.7.4.3), che catalizza la sintesi di ATP e AMP da due molecole di ADP.
ADP + ADP ⇄ ATP + AMP
La Keq della reazione è:
Keq = [ATP][AMP]/[ADP]2= 0,44
In condizioni fisiologiche, le concentrazioni dell’ADP e dell’AMP corrispondono rispettivamente a circa il 10% e, spesso, a meno dell’1% di quella dell’ATP. Pertanto, considerando che il pool dell’adenilato è costante nel breve periodo, anche una piccola variazione nella concentrazione dell’ATP porterà, grazie all’attività della adenilato chinasi, a un aumento relativo molto maggiore della concentrazione dell’AMP. A sua volta l’AMP agisce rimuovendo l’inibizione dovuta all’ATP.
Quindi, l’attività della fosfofruttochinasi-1 dipende dallo stato energetico della cellula:
- quando l’ATP è abbondante l’attività dell’enzima si riduce;
- quando i livelli di AMP aumentano, l’attività dell’enzima aumenta.[9]
Perché l’ADP non è un effettore allosterico positivo di PFK-1
Ci sono due ragioni.
IN primo luogo, quando la carica energetica della cellula si riduce, l’ADP è utilizzato per riformare ATP, nella reazione catalizzata dalla adenilato chinasi.
In secondo luogo, come accennato in precedenza, anche una piccola riduzione nei livelli di ATP porta a variazioni proporzionalmente maggiori nei livelli dell’ADP, e, soprattutto, dell’AMP.[70]
Ruolo degli ioni idrogeno
Gli ioni idrogeno inibiscono la PFK-1. Tale inibizione previene, controllando la velocità della glicolisi, l’eccessivo accumulo di lattato e la conseguente caduta del pH cellulare.[71]
Ruolo del citrato
Il citrato è un inibitore allosterico della fosfofruttochinasi-1 che agisce aumentando l’effetto inibitorio dell’ATP.
Il citrato è il prodotto del primo passaggio del ciclo dell’acido citrico, una via metabolica che fornisce intermedi metabolici per le vie biosintetiche e indirizza gli elettroni verso la catena di trasporto degli elettroni mitocondriale per la sintesi dell’ATP via fosforilazione ossidativa.
Elevati livelli citosolici di citrato indicano che il fabbisogno energetico è soddisfatto e che è disponibile un’abbondanza di precursori biosintetici (esportati dai mitocondri); in altre parole, il ciclo dell’acido citrico ha raggiunto la saturazione.
In tali condizioni, la glicolisi, che alimenta il ciclo in condizioni aerobiche, può rallentare, permettendo quindi un risparmio di glucosio.
Pertanto, va sottolineato che la PFK-1 accoppia funzionalmente la glicolisi al ciclo dell’acido citrico.[65][72]
Regolazione di PFK-1 e FBPasi-1 nel fegato
Nel fegato il punto centrale per la regolazione sia della glicolisi che della gluconeogenesi è rappresentato dal ciclo del substrato tra F6P e F1,6BP, catalizzato dagli enzimi fosfofruttochinasi-1 e fruttosio-1,6-bisfosfatasi.
Il fegato gioca un ruolo cruciale nel mantenimento della glicemia entro valori normali.
Se la glicemia scende, il glucagone a livello epatico stimola la sintesi del glucosio, via glicogenolisi e gluconeogenesi, e al contempo segnala all’organo di non consumare l’esoso per soddisfare i propri fabbisogni.
Quando invece la glicemia è elevata, l’insulina induce il fegato a utilizzare il glucosio per produrre energia, sintetizzare glicogeno e trigliceridi.
In quest’ottica, la regolazione della glicolisi e della gluconeogenesi è mediata dal fruttosio-2,6-bisfosfato (F2,6BP) una molecola che permette all’organo di svolgere un ruolo di primo piano nella regolazione della glicemia e la cui concentrazione è controllata dall’insulina e dal glucagone.[56]
Ruolo del fruttosio-2,6-bisfosfato
A seguito del legame allo specifico sito allosterico sulla fosfofruttochinasi-1, il fruttosio-2,6-bisfosfato aumenta l’affinità dell’enzima per il fruttosio-6-fosfato, il suo substrato, mentre contrasta l’effetto inibitorio di citrato e ATP.
È notevole che, in presenza di concentrazioni fisiologiche dei substrati e degli effettori allosterici, sia positivi che negativi, PFK-1 è praticamente inattiva in assenza di fruttosio-2,6-bisfosfato.
Viceversa, il legame del fruttosio-2,6-bisfosfato alla fruttosio-1,6-bisfosfatasi ne comporta l’inibizione, anche in assenza di AMP, un altro inibitore allosterico dell’enzima.
Grazie a queste azioni F2,6BP aumenta il flusso netto di glucosio attraverso la glicolisi.[66][67][73]
Ruolo dello xilulosio-5-fosfato
Altro metabolita importante per il controllo del flusso del carbonio attraverso la glicolisi e la gluconeogenesi è lo xilulosio-5-fosfato.
È un intermedio della via del pentoso fosfato, la cui concentrazione nell’epatocita aumenta a seguito dell’ingestione di un pasto ricco di carboidrati. La molecola, attivando la protein fosfatasi 2A, porta infine a un aumento della concentrazione del fruttosio-2,6-bisfosfato e quindi a un incremento del flusso glicolitico e alla riduzione di quello attraverso la gluconeogenesi.[74]
Regolazione della piruvato chinasi
Un ulteriore punto di regolazione del flusso di carbonio attraverso la glicolisi e la gluconeogenesi è rappresentato dal ciclo del substrato tra il fosfoenolpiruvato e il piruvato. Suddetto ciclo è catalizzato dalla piruvato chinasi, per la glicolisi, e dall’azione combinata della piruvato carbossilasi e della fosfoenolpiruvato carbossichinasi (EC 4.1.1.32) per la gluconeogenesi.[9]
Regolazione allosterica
Tutte le isoforme della piruvato chinasi sono allostericamente inibite da elevate concentrazioni di ATP, acetil-CoA e acidi grassi a catena lunga, segnali che la cellula si trova in uno stato energetico ottimale. Anche l’alanina, che può essere sintetizzata dal piruvato attraverso una reazione di transaminazione, è un inibitore allosterico dell’enzima; il suo accumulo segnala l’abbondanza di precursori per le vie biosintetiche.
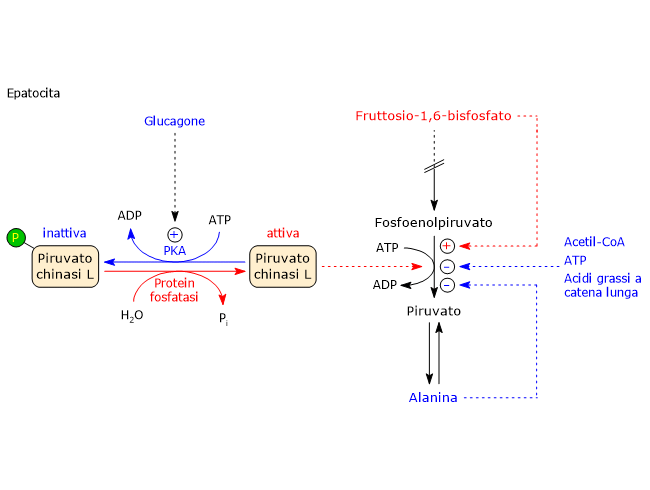
Di contro la piruvato chinasi è allostericamente attivata dal fruttosio-1,6-bisfosfato, il prodotto della prima reazione esclusiva della glicolisi. Questo permette all’enzima di tenere il passo con il flusso di intermedi in arrivo. Va sottolineato il fatto che, in una situazione di concentrazioni fisiologiche di substrato, ossia il PEP, e degli inibitori ATP e alanina, la piruvato chinasi sarebbe completamente inibita senza l’effetto stimolatorio del F1,6BP.[27][75]
Regolazione covalente nel fegato
L’isoenzima epatico, ma non quello muscolare, è soggetto anche a regolazione attraverso fosforilazione a opera della:
- protein chinasi A (PKA), attivata a seguito del legame del glucagone allo specifico recettore o dell’epinefrina ai recettori β-adrenergici;
- protein chinasi calcio/calmodulina dipendente (CAMK), attivata dal legame dell’epinefrina ai recettori α1-adrenergici.
La fosforilazione dell’enzima ne riduce l’attività a seguito di un aumento della sua Km per il PEP, e quindi rallenta la glicolisi.
Ad esempio, a seguito di una riduzione della glicemia, la fosforilazione indotta dal glucagone riduce l’attività dell’enzima. Nella forma fosforilata l’enzima è anche meno responsivo all’attivazione ad opera del fruttosio-1,6-bisfosfato ma più facilmente inibito dall’alanina e dall’ATP.
Di contro, l’enzima in forma defosforilata della piruvato chinasi è più facilmente attivato dal F1,6BP, cioè richiede una concentrazione minore per l’attivazione, e meno sensibile agli inibitori ATP e alanina. In questo modo quando la glicemia è bassa, il fegato rallenta l’utilizzazione del glucosio, e lo zucchero rimane quindi disponibile per altri tessuti e organi, come il cervello.
Va tuttavia notato che l’attivazione da parte di F1,6BP prevale sugli effetti inibitori della fosforilazione operata dalla PKA.
Un aumento del rapporto insulina/glucagone promuove la defosforilazione. Nella forma defosforilata l’enzima è meno sensibile agli inibitori allosterici alanina e ATP, ma più sensibile al suo attivatore allosterico, il fruttosio-1,6-bisfosfato.[9]
Bibliografia
- ^ a b c d e f g h i j k l Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 8th Edition. W.H. Freeman and Company, 2021.
- ^ Alberts B., Johnson A., Lewis J., Morgan D., Raff M., Roberts K., Walter P. Molecular Biology of the Cell. 7th Edition. Garland Science, Taylor & Francis Group, 2022.
- ^ a b c d e f g h Heilman D., Woski S., Voet D., Voet J.G., Pratt C.W. Fundamentals of biochemistry: life at the molecular level. 6th Edition. Wiley, 2023.
- ^ Fruton J.S. A History of Biochemistry. Harvard University Press, 1982.
- ^ a b c d e f g h i j k Garrett R.H., Grisham C.M. Biochemistry. 7th Edition. Cengage Learning, 2023.
- ^ Buchner E., Rapp R. Alkoholische Gärung ohne Hefezellen. Berichte der Deutschen Chemischen Gesellschaft 1899;32(1):127-137. doi:10.1002/cber.18990320124
- ^ Kohler R. The background to Eduard Buchner’s discovery of cell-free fermentation. J Hist Biol 1971;4:35-61. doi:10.1007/BF00356976
- ^ Eduard Buchner – Biographical. NobelPrize.org. Nobel Prize Outreach 2025. Mon. 13 Oct 2025. https://www.nobelprize.org/prizes/chemistry/1907/buchner/biographical/
- ^ a b c d e f g h i j k Stipanuk M.H., Caudill M.A. Biochemical, physiological, and molecular aspects of human nutrition. 4th Edition. St. Louis: Elsevier, 2018.
- ^ Lu Z., Imlay J.A. When anaerobes encounter oxygen: mechanisms of oxygen toxicity, tolerance and defence. Nat Rev Microbiol 2021;19(12):774-785. doi:10.1038/s41579-021-00583-y
- ^ a b c d e f g h i j k l Berg J.M., Tymoczko J.L., Gregory J.G. Jr, Stryer L. Biochemistry. 9th Edition. W.H. Freeman and Company, 2019.
- ^ Plaxton W.C., Podestá F.E. The functional organization and control of plant respiration. Crit Rev Plant Sci 2006;25(2):159-198. doi:10.1080/07352680600563876
- ^ Hochachka P.W., Somero G.N. Biochemical adaptation: mechanism and process in physiological evolution. Oxford University Press, 2002. doi:10.1093/oso/9780195117028.001.0001
- ^ a b Naifeh N., Dimri M., Varacallo M.A. Biochemistry, Aerobic Glycolysis. [Updated 2023 Apr 9]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/sites/books/NBK470170/
- ^ Lunt S.Y., Vander Heiden M.G. Aerobic glycolysis: meeting the metabolic requirements of cell proliferation. Annu Rev Cell Dev Biol 2011;27:441-64. doi:10.1146/annurev-cellbio-092910-154237
- ^ a b c d Wilson J.E. Isozymes of mammalian hexokinase: structure, subcellular localization and metabolic function. J Exp Biol 2003;206(Pt 12):2049-57. doi:10.1242/jeb.00241
- ^ a b c d e f g h i j Atkins P.W., Ratcliffe R.G., Wormald M., De Paula J. Physical chemistry for the life sciences. 3rd Edition. Oxford University Press, 2023.
- ^ Mertens E. Pyrophosphate-dependent phosphofructokinase, an anaerobic glycolytic enzyme? FEBS Lett 1991;285(1):1-5. doi:10.1016/0014-5793(91)80711-b
- ^ Knowles J.R. Enzyme catalysis: not different, just better. Nature 1991;350(6314):121-4. doi:10.1038/350121a0
- ^ Sirover M.A. On the functional diversity of glyceraldehyde-3-phosphate dehydrogenase: biochemical mechanisms and regulatory control. Biochim Biophys Acta 2011;1810(8):741-51. doi:10.1016/j.bbagen.2011.05.010
- ^ Rojas-Pirela M., Andrade-Alviárez D., Rojas V., Kemmerling U., Cáceres A.J., Michels P.A., Concepción J.L., Quiñones W. Phosphoglycerate kinase: structural aspects and functions, with special emphasis on the enzyme from Kinetoplastea. Open Biol 2020;10(11):200302. doi:10.1098/rsob.200302
- ^ Levin S., Almo S.C., Satir B.H. Functional diversity of the phosphoglucomutase superfamily: structural implications. Protein Eng 1999;12(9):737-46. doi:10.1093/protein/12.9.737
- ^ Rapoport S., Luebering J. The formation of 2,3-diphosphoglycerate in rabbit erythrocytes: the existence of a diphosphoglycerate mutase. J Biol Chem 1950;183(2):507-516.
- ^ Webb K.L., Dominelli P.B., Baker S.E., Klassen S.A., Joyner M.J., Senefeld J.W., Wiggins C.C. Influence of high hemoglobin-oxygen affinity on humans during hypoxia. Front Physiol 2022;12:763933. doi:10.3389/fphys.2021.763933
- ^ Li M., Wu C., Yang Y., Zheng M., Yu S., Wang J., Chen L., Li H. 3-Phosphoglycerate dehydrogenase: a potential target for cancer treatment. Cell Oncol (Dordr) 2021;44(3):541-556. doi:10.1007/s13402-021-00599-9
- ^ Lebioda L., Stec B. Mechanism of enolase: the crystal structure of enolase-Mg2+-2-phosphoglycerate/phosphoenolpyruvate complex at 2.2-A resolution. Biochemistry 1991;30(11):2817-22. doi:10.1021/bi00225a012
- ^ a b Schormann N., Hayden K.L., Lee P., Banerjee S., Chattopadhyay D. An overview of structure, function, and regulation of pyruvate kinases. Protein Sci 2019;28(10):1771-1784. doi:10.1002/pro.3691
- ^ Yang Y., Sauve A.A. NAD+ metabolism: bioenergetics, signaling and manipulation for therapy. Biochim Biophys Acta 2016;1864(12):1787-1800. doi:10.1016/j.bbapap.2016.06.014
- ^ Gray L.R., Tompkins S.C., Taylor E.B. Regulation of pyruvate metabolism and human disease. Cell Mol Life Sci 2014;71(14):2577-604. doi:10.1007/s00018-013-1539-2
- ^ Rogatzki M.J., Ferguson B.S., Goodwin M.L., Gladden L.B. Lactate is always the end product of glycolysis. Front Neurosci 2015;9:22. doi:10.3389/fnins.2015.00022
- ^ Geison G.L. The Private Science of Louis Pasteur. Princeton University Press, 1995.
- ^ a b c d e Rodwell V.W., Bender D.A., Botham K.M., Kennelly P.J., Weil P.A. Harper’s Illustrated Biochemistry. 31st Edition. McGraw-Hill, 2018.
- ^ Dong S., Qian L., Cheng Z., Chen C., Wang K., Hu S., Zhang X., Wu T. Lactate and myocardiac energy metabolism. Front Physiol 2021;12:715081. doi:10.3389/fphys.2021.715081
- ^ National Research Council (US) Panel on the Applications of Biotechnology to Traditional Fermented Foods. Applications of Biotechnology to Fermented Foods: Report of an Ad Hoc Panel of the Board on Science and Technology for International Development. Washington (DC): National Academies Press (US); 1992. 5, Lactic Acid Fermentations. Available from: https://www.ncbi.nlm.nih.gov/books/NBK234703/
- ^ Dzialo M.C., Park R., Steensels J., Lievens B., Verstrepen K.J. Physiology, ecology and industrial applications of aroma formation in yeast. FEMS Microbiol Rev 2017;41(Supp_1):S95-S128. doi:10.1093/femsre/fux031
- ^ Maicas S. The role of yeasts in fermentation processes. Microorganisms 2020;8(8):1142. doi:10.3390/microorganisms8081142
- ^ Patel M.S., Nemeria N.S., Furey W., and Jordan F. The pyruvate dehydrogenase complexes: structure-based function and regulation. J Biol Chem 2014;289(24):16615-16623. doi:10.1074/jbc.R114.563148
- ^ Liu H., Wang S., Wang J., Guo X., Song Y., Fu K., Gao Z., Liu D., He W., Yang L.L. Energy metabolism in health and diseases. Signal Transduct Target Ther 2025;10(1):69. doi:10.1038/s41392-025-02141-x
- ^ Borst P. The malate-aspartate shuttle (Borst cycle): How it started and developed into a major metabolic pathway. IUBMB Life 2020;72(11):2241-2259. doi:10.1002/iub.2367
- ^ a b Ahmad M., Wolberg A., Kahwaji C.I. Biochemistry, Electron Transport Chain. [Updated 2023 Sep 4]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK526105/
- ^ Chaudhry R., Varacallo M.A. Biochemistry, Glycolysis. [Updated 2023 Aug 8]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK482303/
- ^ DeBerardinis R.J., Chandel N.S. Fundamentals of cancer metabolism. Sci Adv 2016;2(5):e1600200. doi:10.1126/sciadv.1600200
- ^ Melkonian E.A., Schury M.P. Biochemistry, Anaerobic Glycolysis. [Updated 2023 Jul 31]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK546695/
- ^ Chandel N.S. Glycolysis. Cold Spring Harb Perspect Biol. 2021;13(5):a040535. doi:10.1101/cshperspect.a040535
- ^ Chandel N.S. Carbohydrate Metabolism. Cold Spring Harb Perspect Biol 2021;13(1):a040568. doi:10.1101/cshperspect.a040568
- ^ Kiela P.R., Ghishan F.K. Physiology of intestinal absorption and secretion. Best Pract Res Clin Gastroenterol 2016;30(2):145-59. doi:10.1016/j.bpg.2016.02.007
- ^ a b Dholariya S.J., Orrick J.A. Biochemistry, Fructose Metabolism. [Updated 2022 Oct 17]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK576428/
- ^ a b Hannou S.A., Haslam D.E., McKeown N.M., Herman M.A. Fructose metabolism and metabolic disease. J Clin Invest 2018;128(2):545-555. doi:10.1172/JCI96702
- ^ Legeza B., Marcolongo P., Gamberucci A., Varga V., Bánhegyi G., Benedetti A., Odermatt A. Fructose, glucocorticoids and adipose tissue: implications for the metabolic syndrome. Nutrients 2017;9(5):426. doi:10.3390/nu9050426
- ^ Frey P.A. The Leloir pathway: a mechanistic imperative for three enzymes to change the stereochemical configuration of a single carbon in galactose. FASEB J 1996;10(4):461-70. doi:10.1096/fasebj.10.4.8647345
- ^ Conte F., van Buuringen N., Voermans N.C., Lefeber D.J. Galactose in human metabolism, glycosylation and congenital metabolic diseases: time for a closer look. Biochim Biophys Acta Gen Subj 2021;1865(8):129898. doi:10.1016/j.bbagen.2021.129898
- ^ Succoio M., Sacchettini R., Rossi A., Parenti G., Ruoppolo M. Galactosemia: biochemistry, molecular genetics, newborn screening, and treatment. Biomolecules 2022;12(7):968. doi:10.3390/biom12070968
- ^ Sharma V., Ichikawa M., Freeze H.H. Mannose metabolism: more than meets the eye. Biochem Biophys Res Commun 2014;453(2):220-8. doi:10.1016/j.bbrc.2014.06.021
- ^ a b de la Iglesia N., Mukhtar M., Seoane J., Guinovart J.J., Agius L. The role of the regulatory protein of glucokinase in the glucose sensory mechanism of the hepatocyte. J Biol Chem 2000;275(14):10597-10603. doi: 10.1074/jbc.275.14.10597
- ^ Zhang Y., Lin Z., Wang M., Lin H. Selective usage of isozymes for stress response. ACS Chem Biol 2018;13(11):3059-3064. doi:10.1021/acschembio.8b00767
- ^ a b Han H.S., Kang G., Kim J.S., Choi B.H., Koo S.H. Regulation of glucose metabolism from a liver-centric perspective. Exp Mol Med 2016;48(3):e218. doi:10.1038/emm.2015.122
- ^ Huang S., Czech M.P. The GLUT4 glucose transporter. Cell Metab 2007;5(4):237-52. doi:10.1016/j.cmet.2007.03.006
- ^ Matschinsky F.M., Magnuson M.A., Zelent D., Jetton T.L., Doliba N., Han Y., Taub R., Grimsby J. The network of glucokinase-expressing cells in glucose homeostasis and the potential of glucokinase activators for diabetes therapy. Diabetes 2006;55(1):1-12. doi:diabetes.55.01.06.db05-0926
- ^ Sun B., Chen H., Xue J., Li P., Fu X. The role of GLUT2 in glucose metabolism in multiple organs and tissues. Mol Biol Rep 2023;50(8):6963-6974. doi:10.1007/s11033-023-08535-w
- ^ a b Adeva-Andany M.M., Pérez-Felpete N., Fernández-Fernández C., Donapetry-García C., Pazos-García C. Liver glucose metabolism in humans. Biosci Rep 2016;36(6):e00416. doi:10.1042/BSR20160385
- ^ Abu Aqel Y., Alnesf A., Aigha I.I., Islam Z., Kolatkar P.R., Teo A., Abdelalim E.M. Glucokinase (GCK) in diabetes: from molecular mechanisms to disease pathogenesis. Cell Mol Biol Lett. 2024 Sep 8;29(1):120. doi:10.1186/s11658-024-00640-3
- ^ Kaminski M.T., Schultz J., Waterstradt R., Tiedge M., Lenzen S., Baltrusch S. Glucose-induced dissociation of glucokinase from its regulatory protein in the nucleus of hepatocytes prior to nuclear export. Biochim Biophys Acta 2014;1843(3):554-564. doi:10.1016/j.bbamcr.2013.12.002
- ^ Sternisha S.M., Miller B.G. Molecular and cellular regulation of human glucokinase. Arch Biochem Biophys 2019;663:199-213. doi:10.1016/j.abb.2019.01.011
- ^ Matschinsky F.M., Wilson D.F. The central role of glucokinase in glucose homeostasis: a perspective 50 years after demonstrating the presence of the enzyme in islets of Langerhans. Front Physiol 2019;10:148. doi:10.3389/fphys.2019.00148
- ^ a b Mor I., Cheung E.C., Vousden K.H. Control of glycolysis through regulation of PFK1: old friends and recent additions. Cold Spring Harb Symp Quant Biol 2011;76:211-6. doi:10.1101/sqb.2011.76.010868
- ^ a b Van Schaftingen E., and Hers H-G. Inhibition of fructose-1,6-bisphosphatase by fructose-2,6-bisphosphate. Proc Natl Acad Sci USA 1981;78(5):2861-2863. doi:10.1073/pnas.78.5.2861
- ^ a b Van Schaftingen E., Jett M-F., Hue L., and Hers H-G. Control of liver 6-phosphofructokinase by fructose 2,6-bisphosphate and other effectors. Proc Natl Acad Sci USA 1981;78(6):3483-3486. doi:10.1073/pnas.78.6.3483
- ^ Lynch E.M., Hansen H., Salay L., Cooper M., Timr S., Kollman J.M., Webb B.A. Structural basis for allosteric regulation of human phosphofructokinase-1. Nat Commun 2024;15(1):7323. doi:10.1038/s41467-024-51808-6
- ^ Jenkins C.M., Yang J., Sims H.F., Gross R.W. Reversible high affinity inhibition of phosphofructokinase-1 by acyl-CoA: a mechanism integrating glycolytic flux with lipid metabolism. J Biol Chem 2011;286(14):11937-50. doi:10.1074/jbc.M110.203661
- ^ Atkinson D.E. The energy charge of the adenylate pool as a regulatory parameter. Interaction with feedback modifiers. Biochemistry 1968;7(11):4030-4. doi:10.1021/bi00851a033
- ^ Lešnik S., Konc J., Vodopivec T., Čamernik K., Karolina Potokar U., Legiša M. Small-molecule inhibitors of 6-phosphofructo-1-kinase simultaneously suppress lactate and superoxide generation in cancer cells. PLoS One 2025;20(5):e0321998. doi:10.1371/journal.pone.0321998
- ^ Usenik A., Legiša M. Evolution of allosteric citrate binding sites on 6-phosphofructo-1-kinase. PLoS One 2010;5(11):e15447. doi:10.1371/journal.pone.0015447
- ^ Chaekal O.K., Boaz J.C., Sugano T., Harris R.A. Role of fructose 2,6-bisphosphate in the regulation of glycolysis and gluconeogenesis in chicken liver. Arch Biochem Biophys 1983;225(2):771-8. doi:10.1016/0003-9861(83)90088-7
- ^ Kabashima T., Kawaguchi T., Wadzinski B.E., Uyeda K. Xylulose 5-phosphate mediates glucose-induced lipogenesis by xylulose 5-phosphate-activated protein phosphatase in rat liver. Proc Natl Acad Sci USA 2003;100:5107-5112. doi:10.1073/pnas.0730817100
- ^ Jurica M.S., Mesecar A., Heath P.J., Shi W., Nowak T., Stoddard B.L. The allosteric regulation of pyruvate kinase by fructose-1,6-bisphosphate. Structure 1998;6(2):195-210. doi:10.1016/s0969-2126(98)00021-5