L’acido piruvico, un α-chetoacido, è una molecola con un ruolo centrale nel metabolismo cellulare.[1][2]
Può essere prodotto attraverso diverse vie metaboliche, per la maggior parte citosoliche, tra le quali glicolisi è di solito la più importante, mentre il suo destino dipende dal tipo di cellula e dalla disponibilità di ossigeno, potendo essere utilizzato sia a fini energetici, biosintetici e anaplerotici.[3]
Dato il suo ruolo centrale nel metabolismo cellulare, mutazioni a carico dei geni che codificano per le proteine coinvolte nel suo metabolismo sono causa, nell’uomo, di malattie da lievi a gravi.[4]
Indice
Proprietà chimiche
L’acido piruvico o, secondo la nomenclatura IUPAC, l’acido 2-ossopropanoico, ha formula molecolare C3H4O3, formula condensata CH3COCOOH, e peso molecolare di 88,06 g/mol.
È classificato tra gli α-chetoacidi, ossia chetoacidi dove il gruppo carbonilico è adiacente al carbonio carbossilico. Tra gli α-chetoacidi è quello con la struttura chimica più semplice.[1]
In forma purificata si presenta come un liquido incolore, con un odore che ricorda quello dell’acido acetico.
La sua costante di dissociazione o pKa, a 25 °C, è pari a 2,45. Si tratta dunque di un acido molto forte. Pertanto a pH fisiologico, sia nelle cellule che nei fluidi extracellulari, è presente quasi totalmente nella sua forma anionica, il piruvato.
Il suo punto di fusione è pari a 13,8 °C (56,84 °F; 286,95 K), mentre il punto di ebollizione è pari a 163,5 °C (329 °F; 438 K).[1]
Metabolismo del piruvato
Le vie metaboliche che portano alla sintesi dell’acido piruvico, nonché il suo successivo utilizzo, dipendono dal tipo di cellula e/o dalla disponibilità di ossigeno.[3]
Nelle cellule dotate di mitocondri, il metabolismo del piruvato si compone di una fase citosolica e una mitocondriale.
Nel citosol diverse vie metaboliche portano alla sua formazione. Tra queste, la glicolisi, l’ossidazione del lattato, la reazione catalizzata dall’enzima malico citosolico, e il catabolismo di almeno sei aminoacidi. L’alanina, il più importante tra questi, insieme al lattato, può produrre acido piruvico anche nella matrice mitocondriale.[5]
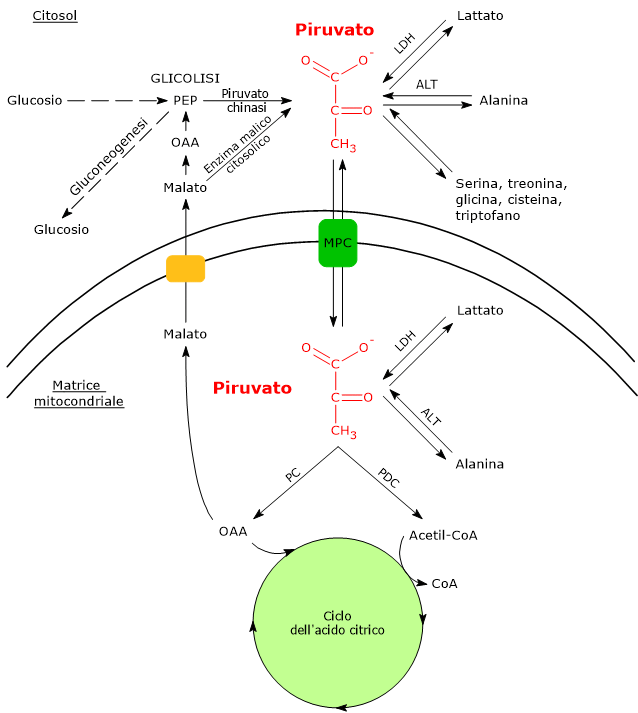 L’acido piruvico prodotto nel citosol, tramite trasportatori specifici, entra nel mitocondrio dove potrà essere utilizzato a fini energetici, entrando nel ciclo dell’acido citrico, e/o biosintetici/anaplerotici, sulla base delle necessità della cellula.[6]
L’acido piruvico prodotto nel citosol, tramite trasportatori specifici, entra nel mitocondrio dove potrà essere utilizzato a fini energetici, entrando nel ciclo dell’acido citrico, e/o biosintetici/anaplerotici, sulla base delle necessità della cellula.[6]
Se invece si considerano le cellule prive di mitocondri, come i globuli rossi, e, in condizioni di ipossia, anche le cellule dotate di mitocondri, il piruvato è ridotto a lattato e/o lascia la cellula come tale per essere quindi metabolizzato in altri tessuti, ad esempio il muscolo cardiaco.[7]
Glicolisi
In condizioni fisiologiche nella maggior parte delle cellule l’acido piruvico deriva principalmente dalla glicolisi, di cui ne rappresenta uno dei tre prodotti, con l’ATP e il NADH.
Nell’ultima reazione della via glicolitica la piruvato chinasi (EC 2.7.1.40) catalizza una fosforilazione a livello del substrato che porta al trasferimento del gruppo fosforico dal fosfoenolpiruvato all’ADP. La reazione, essenzialmente irreversibile, porta dalla formazione di una molecola di ATP e una di piruvato.
Fosfoenolpiruvato + ADP + H+ → Piruvato + ATP
Dunque, a mezzo della via glicolitica, da una molecola di glucosio sono prodotte due molecole di piruvato, oltre che di ATP e NADH.[2][8]
Lattato deidrogenasi
Nel citosol l’acido piruvico può essere prodotto dall’acido lattico.
L’enzima lattato deidrogenasi o LDH (EC 1.1.1.27) catalizza la conversione, reversibile, del piruvato a lattato e del NADH a NAD+.
Piruvato + NADH + H+ ⇄ Lattato + NAD+
La direzione della reazione dipende dagli isozimi della lattato deidrogenasi presenti e dal rapporto NADH/NAD+ nel citosol.[3][5]
Gli isozimi in cui predomina la subunità H, come LDH-1, predominano nel muscolo cardiaco, un tessuto completamente aerobico, dove catalizzano l’ossidazione del lattato, proveniente da altri tessuti, a piruvato, che sarà quindi utilizzato a fini energetici.
L’ossidazione del lattato prodotto ad esempio dai globuli rossi o dal muscolo scheletrico che lavora in condizioni ipossiche, può avvenire anche negli epatociti, favorita dal basso rapporto NADH/NAD+ nel citosol, sebbene l’isozima prevalente sia LDH-5. Nell’epatocita l’acido piruvico prodotto potrà essere utilizzato nella gluconeogenesi, che in questo caso è parte del più ampio ciclo di Cori, o essere ossidato a fini energetici.[9]
Di contro, nella fibra muscolare scheletrica che lavora in condizioni ipossiche, essendo inibito il complesso della piruvato deidrogenasi e bloccata fosforilazione ossidativa, perché la glicolisi possa procedere, il piruvato sarà ridotto a lattato con la concomitante ossidazione del NADH a NAD+.[10] Si noti che la conversione del glucosio in acido lattico è definita fermentazione lattica. Tale riduzione è favorita dal fatto che nella fibra muscolare scheletrica predominano isoenzimi con prevalenza della subunità M, quali LDH-4 e LDH-5.[11]
Alanina aminotransferasi
Un’altra fonte di acido piruvico è rappresentata dalla alanina, un aminoacido particolarmente abbondante nelle proteine muscolari.
L’utilizzazione degli scheletri carboniosi degli aminoacidi a fini energetici e anabolici implica la rimozione del gruppo amminico, che si verifica in reazioni catalizzate da enzimi chiamati transaminasi (EC 2.6.1-), e il successivo smaltimento dell’azoto in forma non tossica, attraverso il ciclo dell’urea.[2][8]
La rimozione del gruppo amminico dell’alanina è catalizzata dalla alanina aminotransferasi (ALT; EC 2.6.1.2). La reazione, reversibile, porta alla formazione di piruvato e glutammato.
Alanina + α-Chetoglutarato ⇄ Piruvato + Glutammato
Sono state identificate due forme della ALT, una a localizzazione citosolica, ALT1, e l’altra presente nella matrice mitocondriale, indicata come ALT2.[4] Ne risulta che l’acido piruvico può essere prodotto per transaminazione dell’alanina anche nella matrice mitocondriale.
L’alanina è uno dei principali precursori gluconeogenetici, e, tramite il ciclo glucosio-alanina, rappresenta un collegamento tra il metabolismo degli aminoacidi e quello dei carboidrati.[12]
Nel citosol gli scheletri carboniosi di altri cinque aminoacidi, ossia cisteina, glicina, serina, treonina e triptofano, possono essere convertiti in toto o in parte in piruvato.[2]
Enzima malico
Altra fonte piruvato è il malato.
Nella reazione, catalizzata dall’enzima malico citosolico, una decarbossilazione ossidativa (EC 1.1.1.40), il malato subisce una decarbossilazione ossidativa a dare piruvato.[3]
Malato + NADP+ → Piruvato + CO2 + NADPH + H+
L’enzima svolge un ruolo importante nel trasporto di intermedi del ciclo dell’acido citrico, quali, oltre al malato, l’ossalacetato e il citrato, tra il citosol e la matrice mitocondriale.[7]
Trasportatori mitocondriali del piruvato
Nelle cellule dotate di mitocondri, la maggior parte del piruvato prodotto nel citoplasma passa nella matrice mitocondriale, superando prima la membrana mitocondriale esterna e quindi quella interna.
Una volta nella matrice mitocondriale il piruvato può essere utilizzato sia per fini anabolici che catabolici.
Il passaggio attraverso la membrana mitocondriale esterna avviene per libera diffusione mediata dalle porine o VDAC, dall’inglese voltage dependent anion-selective channels, canali anionici voltaggio-dipendenti relativamente non specifici, nonché le più proteine più abbondanti della membrana mitocondriale esterna, la cui funzione è quella di mediare lo scambio di ioni e piccole molecole, tra cui oltre al piruvato anche l’ATP e il NADH, tra il citosol e lo spazio intermembrana dei mitocondri.[13][14]
La membrana mitocondriale interna è invece impermeabile alle molecole dotate di carica, il che permette il mantenimento del gradiente protonico necessario alla fosforilazione ossidativa. Ne consegue che il passaggio del piruvato necessita di specifici trasportatori, indicati come MPC, dall’inglese mitochondrial pyruvate carriers, un complesso etero-oligomerico di due subunità indicate come MPC1 e MPC2, che operano un simporto di protoni. Questi trasportatori legano quindi il metabolismo citosolico e mitocondriale del piruvato.[15][16]
Complesso della piruvato deidrogenasi
Una volta nella matrice mitocondriale, l’acido piruvico è per la maggior parte ossidato ad anidride carbonica al fine di supportare la produzione di ATP.
Il primo passaggio di questo processo di ossidazione vede l’intervento del complesso della piruvato deidrogenasi, uno tra i più importanti complessi multienzimatici presenti nelle cellule. Il complesso catalizza la decarbossilazione ossidativa del piruvato, con formazione di acetil-CoA e di una molecola di anidride carbonica, con il rilascio di due elettroni, che sono trasportati dal NADH.
Piruvato + CoA + NAD+ → Acetil-CoA + NADH + H+ + CO2
Il gruppo acetilico può ora entrare nel ciclo dell’acido citrico per essere completamente ossidato ad anidride carbonica, con produzione di una molecola di GTP, 3 molecole di NADH, una di FADH2. I due coenzimi ridotti, mediante la fosforilazione ossidativa, permetteranno la formazione di ulteriori molecole di ATP.[2]
In alternativa, il gruppo acetilico derivante dal piruvato può essere utilizzato a fini anabolici, tra cui la sintesi di alcuni lipidi quali gli acidi grassi, i fosfolipidi e il colesterolo, o essere utilizzato a fini regolatori a mezzo dell’acetilazione degli istoni.
Poiché la biosintesi dei lipidi si verifica nel citosol e l’acetilazione degli istoni nel nucleo, l’acetil-CoA dovrà lasciare la matrice mitocondriale, processo che necessita della formazione di citrato, a mezzo della condensazione tra il gruppo acetilico e il carbonile dell’ossalacetato, reazione catalizzata dalla citrato sintasi (EC 2.3.3.1).
Una volta raggiunto il citosol, a mezzo di un trasportatore del citrato, una proteina integrale della membrana mitocondriale interna, il citrato viene scisso ad acetil-CoA e ossalacetato nella reazione catalizzata dalla citrato liasi (EC 4.1.3.6).[17]
Piruvato carbossilasi
Nella matrice mitocondriale l’acido piruvico può essere carbossilato a ossalacetato in una reazione, irreversibile catalizzata dalla piruvato carbossilasi o PC (EC 6.4.1.1).[8]
Piruvato + HCO3− + ATP ⇄ Ossalacetato + ADP + Pi
Molti intermedi del ciclo dell’acido citrico sono anche precursori per la sintesi di diverse molecole. Ne consegue che ognuno di questi intermedi rimossi dal ciclo dell’acido citrico dovrà essere reintegrato perché il ciclo possa proseguire. Le reazioni che reintegrano il ciclo sono definite anaplerotiche. In quest’ottica, la reazione catalizzata dalla piruvato carbossilasi svolge una funzione anaplerotica catalizzando la formazione di ossalacetato dal piruvato.[6]
Bibliografia
- ^ a b c National Center for Biotechnology Information. PubChem Compound Summary for CID 1060, Pyruvic Acid. https://pubchem.ncbi.nlm.nih.gov/compound/Pyruvic-Acid. Accessed Aug. 19, 2024
- ^ a b c d e Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 8th Edition. W.H. Freeman and Company, 2021.
- ^ a b c d Berg J.M., Tymoczko J.L., Gregory J.G. Jr, Stryer L. Biochemistry. 9th Edition. W.H. Freeman and Company, 2019.
- ^ a b Gray L.R., Tompkins S.C., Taylor E.B. Regulation of pyruvate metabolism and human disease. Cell Mol Life Sci 2014;71(14):2577-604. doi:10.1007/s00018-013-1539-2
- ^ a b Markert C.L., Shaklee J.B., Whitt G.S. Evolution of a gene. Multiple genes for LDH isozymes provide a model of the evolution of gene structure, function and regulation. Science 1975;189(4197):102-14. doi:10.1126/science.1138367
- ^ a b Owen O.E., Kalhan S.C., Hanson R.W. The key role of anaplerosis and cataplerosis for citric acid cycle function. J Biol Chem 2002;277(34):30409-12. doi:10.1074/jbc.R200006200
- ^ a b McCommis K.S. and Finck B.N. Mitochondrial pyruvate transport: a historical perspective and future research directions. Biochem J 2015;466(3):443-454. doi:10.1042/BJ20141171
- ^ a b c Moran L.A., Horton H.R., Scrimgeour K.G., Perry M.D. Principles of Biochemistry. 5th Edition. Pearson, 2012.
- ^ Gleeson T.T. Post-exercise lactate metabolism: a comparative review of sites, pathways, and regulation. Annu Rev Physiol 1996;58:565-81. doi:10.1146/annurev.ph.58.030196.003025
- ^ Li X., Yang Y., Zhang B., Lin X., Fu X., An Y., Zou Y., Wang J.X., Wang Z., Yu T. Lactate metabolism in human health and disease. Signal Transduct Target Ther 2022;7(1):305. doi:10.1038/s41392-022-01151-3
- ^ Farhana A., Lappin S.L. Biochemistry, lactate dehydrogenase. [Updated 2023 May 1]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK557536/
- ^ Felig P., Pozefsk T., Marlis E., Cahill G.F. Alanine: key role in gluconeogenesis. Science 1970;167(3920):1003-1004. doi:10.1126/science.167.3920.1003
- ^ Colombini M. The VDAC channel: molecular basis for selectivity. Biochim Biophys Acta 2016;1863(10):2498-502. doi:10.1016/j.bbamcr.2016.01.019
- ^ Young M.J., Bay D.C., Hausner G., Court D.A. The evolutionary history of mitochondrial porins. BMC Evol Biol 2007;7:31. doi:10.1186/1471-2148-7-31
- ^ Bricker D.K., Taylor E.B., Schell J.C., Orsak T., Boutron A., Chen Y.C., Cox J.E., Cardon C.M., Van Vranken J.G., Dephoure N., Redin C., Boudina S., Gygi S.P., Brivet M., Thummel C.S., Rutter J. A mitochondrial pyruvate carrier required for pyruvate uptake in yeast, Drosophila, and humans. Science 2012;337(6090):96-100. doi:10.1126/science.1218099
- ^ Herzig S., Raemy E., Montessuit S., Veuthey J.L., Zamboni N., Westermann B., Kunji E.R., Martinou J.C. Identification and functional expression of the mitochondrial pyruvate carrier. Science 2012;337(6090):93-6. doi:10.1126/science.1218530
- ^ Zara V., Assalve G., Ferramosca A. Multiple roles played by the mitochondrial citrate carrier in cellular metabolism and physiology. Cell Mol Life Sci 2022;79(8):428. doi:10.1007/s00018-022-04466-0