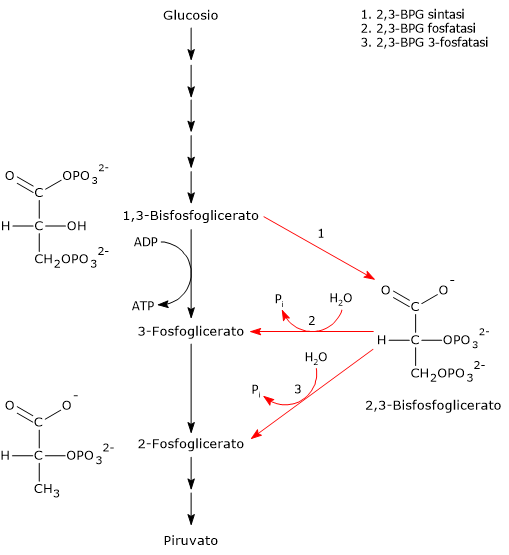
Lo shunt di Rapoport-Luebering è una via metabolica presente prevalentemente nei globuli rossi ed è una deviazione dalla via glicolitica, da cui si diparte a livello dell’1,3-bisfosfoglicerato.[1][2]
Le due reazioni dello shunt sono catalizzate da un enzima multifunzionale, la bisfosfoglicerato mutasi (EC 5.4.2.4). Tuttavia di recente è stato identificato un secondo enzima che partecipa allo shunt, la 2,3-bisfosfoglicerato 3-fosfatasi (EC 3.1.3.80).[3]
Il prodotto più importante è il 2,3-bisfosfoglicerato (2,3-BPG), un effettore allosterico dell’emoglobina di cui riduce l’affinità per l’ossigeno molecolare, concorrendo così a regolarne il rilascio a livello tissutale.[4][5]
Essendo una deviazione dalla via glicolitica a monte delle reazioni che portano alla sintesi di ATP, lo shunt di Rapoport-Luebering comporta un costo energetico per la cellula.[3]
Difetti a carico degli enzimi glicolitici dei globuli rossi determinano anomalie nella sintesi del 2,3-BPG, e di conseguenza nell’affinità dell’emoglobina per l’ossigeno molecolare.[6]
Indice
- Bisfosfoglicerato mutasi
- Reazioni
- 2,3-Bisfosfoglicerato 3-fosfatasi
- Ruolo dello shunt di Rapoport-Luebering
- Costo energetico dello shunt di Rapoport-Luebering
- Rapporto tra glicolisi e shunt di Rapoport-Luebering
- Bibliografia
Bisfosfoglicerato mutasi
La bisfosfoglicerato mutasi è un enzima centrale nello shunt di Rapoport-Luebering, e si ritrova nei globuli rossi.[4]
E’ un enzima multifunzionale essendo una 2,3-bisfosfoglicerato sintasi e una 2,3-bisfosfoglicerato fosfatasi. Inoltre è anche una 2,3-bisfosfoglicerato mutasi, attività analoga a quella della fosfoglicerato mutasi glicolitica (EC 5.4.2.1), ma che non partecipa allo shunt. Le tre attività catalitiche avvengono nello stesso sito attivo, con l’attività di sintasi come attività principale, che è inibita dal 2,3-bisfosfoglicerato libero.[7][8]
 L’attività di fosfatasi è bassa, circa 1000 volte inferiore all’attività di sintasi, ed è stimolata da diversi anioni, come cloruro, fosfato, solfito e, in modo più marcato, dal 2-fosfoglicolato.[9]
L’attività di fosfatasi è bassa, circa 1000 volte inferiore all’attività di sintasi, ed è stimolata da diversi anioni, come cloruro, fosfato, solfito e, in modo più marcato, dal 2-fosfoglicolato.[9]
Sembra infine che l’attività di mutasi sia fisiologicamente non significativa, catalizzando circa il 5% della conversione reversibile del 3-fosfoglicerato a 2-fosfoglicerato.[10][11]
La bisfosfoglicerato mutasi è una delle tre isoforme con cui nei mammiferi è presente la fosfoglicerato mutasi. Le altre due isoforme sono la fosfoglicerato mutasi 1 o tipo M, presente nel muscolo, e la fosfoglicerato mutasi 2 o tipo B presente in tutti gli altri tessuti. Anche queste due isoforme sono enzimi trifunzionali.[4]
Reazioni
Lo shunt di Rapoport-Luebering si compone di due reazioni.
Nella prima la bisfosfoglicerato mutasi, agendo come sintasi, catalizza l’isomerizzazione dell’1,3-bisfosfoglicerato (1,3-BPG) a 2,3- bisfosfoglicerato (2,3-BPG). L’enzima necessita della presenza del 3-fosfoglicerato in quanto catalizza il trasferimento intermolecolare di un gruppo fosforico dal C-1 dell’1,3-bisfosfoglicerato al C-2 del 3-fosfoglicerato. Nella reazione quindi il 3-fosfoglicerato di partenza diviene il 2,3-BPG, mentre l’1,3-BPG diviene il nuovo 3-fosfoglicerato.[12]
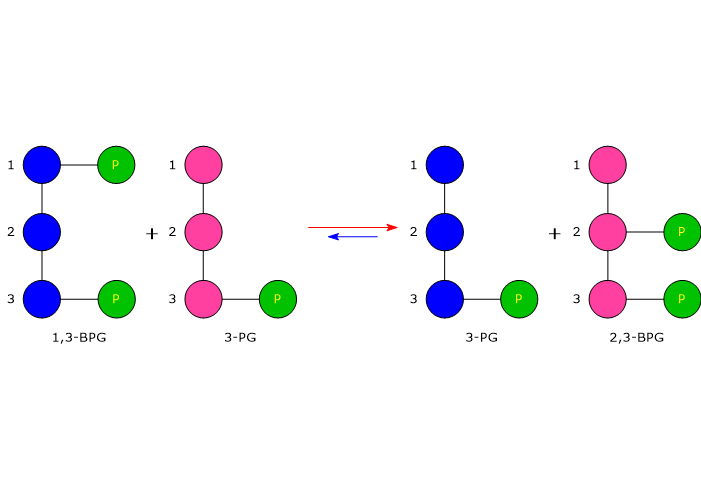 Nel secondo passaggio l’attività fosfatasica della bisfosfoglicerato mutasi catalizza la sintesi del 3-fosfoglicerato, un intermedio glicolitico, a seguito dell’idrolisi del gruppo fosforico in posizione C-2 del 2,3-BPG.Il 3-fosfoglicerato prodotto può quindi rientrare nella via glicolitica a livello della reazione catalizzata dalla fosfoglicerato mutasi, ossia l’ottava tappa della via.[5]
Nel secondo passaggio l’attività fosfatasica della bisfosfoglicerato mutasi catalizza la sintesi del 3-fosfoglicerato, un intermedio glicolitico, a seguito dell’idrolisi del gruppo fosforico in posizione C-2 del 2,3-BPG.Il 3-fosfoglicerato prodotto può quindi rientrare nella via glicolitica a livello della reazione catalizzata dalla fosfoglicerato mutasi, ossia l’ottava tappa della via.[5]
2,3-Bisfosfoglicerato 3-fosfatasi
E’ stato identificato un secondo enzima coinvolto nello shunt Rapoport-Luebering.
Oltre alla bisfosfoglicerato mutasi, è stata scoperta un’attività di 2,3-bisfosfoglicerato 3-fosfatasi catalizzata da una inositolo polifosfato fosfatasi multipla evolutivamente conservata, nota come MIPP1, che è stata trovata nelle amebe del genere Dictyostelium, negli uccelli e nei mammiferi.
Questa scoperta rivela quindi che la formazione di 3-fosfoglicerato, un precursore per la biosintesi della serina e un attivatore della proteina chinasi attivata da AMP, può essere bypassata. Manipolando geneticamente l’espressione di MIPP1 in Dictyostelium, è stato dimostrato il ruolo fisiologicamente rilevante dell’enzima nella regolazione del contenuto cellulare di 2,3-BPG.[3]
Ruolo dello shunt di Rapoport-Luebering
Lo shunt di Rapoport-Luebering porta alla formazione del 2,3-bisfosfoglicerato, che con l’anidride carbonica e gli ioni idrogeno, è uno degli effettori allosterici dell’emoglobina.[5]
Il 2,3-bisfosfoglicerato è presente in elevate concentrazioni nel globulo rosso dell’uomo, mentre nelle altre cellule è presente in tracce.[6] Nella maggior parte dei primati e molti altri mammiferi riduce l’affinità dell’emoglobina per l’ossigeno molecolare, facilitandone così il rilascio ai tessuti.[3]
Il 2,3-BPG si lega alla deossiemoglobina a mezzo di legami ionici con le catene β nello stato T, stato nel quale queste subunità formano una tasca elettrostatica complementare sia alla conformazione che alla distribuzione di carica della molecola. Il legame stabilizza lo stato T, quindi la deossiemoglobina, ed è principalmente responsabile della natura cooperativa del legame dell’ossigeno molecolare da parte dell’emoglobina.[12]
In tracce, il 2,3-bisfosfoglicerato è anche necessario all’attività catalitica della fosfoglicerato mutasi. Ne consegue che un’altra funzione della bisfosfoglicerato mutasi, e quindi dello shunt di Rapoport-Luebering, è quella di controllare il livello degli intermedi glicolitici.[13]
Costo energetico dello shunt di Rapoport-Luebering
L’1,3-bisfoglicerato è un intermedio della via glicolitica. Infatti, nella settima tappa della glicolisi, la fosfoglicerato chinasi (EC 2.7.2.3) catalizzata il trasferimento del gruppo fosforico ad alta energia presente sul C-1 dell’1,3-bisfosfoglicerato all’ADP, con formazione di ATP e 3-fosfoglicerato. La reazione, una fosforilazione a livello del substrato, è la prima delle due reazioni della via glicolitica in cui parte dell’energia chimica contenuta nel glucosio viene conservata in forma di ATP.[5]
Pertanto, l’ingresso dell’1,3-bisfosfoglicerato nel ciclo di Rapoport-Leubering comporta un costo energetico pari due molecole di ATP per molecola di 1,3-bisfosfoglicerato che devia dalla glicolisi ed entra nello shunt.[3] Ne consegue che esiste un delicato equilibrio tra il fabbisogno energetico del globulo rosso e la necessità di mantenere l’emoglobina in un adeguato stato di ossigenazione e deossigenazione.[14]
Rapporto tra glicolisi e shunt di Rapoport-Luebering
In condizioni fisiologiche, nei globuli rossi lo shunt di Rapoport-Luebering intercetta circa il 20% del flusso glicolitico.[8] Pertanto difetti a carico di enzimi glicolitici eritrocitari influenzano lo shunt, e quindi l’affinità dell’emoglobina per l’ossigeno molecolare.[6]
Due condizioni che evidenziano tale connessione sono l’anemia emolitica non sferocitica da deficit di esochinasi e l’anemia emolitica da deficit di piruvato chinasi negli eritrociti, malattie a trasmissione autosomica recessiva.[15][16]
Nell’anemia emolitica non sferocitica da deficit di esochinasi c’è una carenza di esochinasi eritrocitaria (EC 2.7.1.1).[17] L’enzima catalizza la fosforilazione del glucosio a glucosio-6-fosfato, e un suo deficit comporta una diminuzione della concentrazione eritrocitaria di 2,3-BPG, e quindi un aumento dell’affinità dell’emoglobina per l’ossigeno molecolare.[6]
Di contro, nell’anemia emolitica da deficit di piruvato chinasi negli eritrociti c’è una carenza della piruvato chinasi (EC 2.7.1.40), che ha come conseguenze un aumento della sintesi del 2,3-BPG e una diminuzione dell’affinità dell’emoglobina per l’ossigeno molecolare.[18]
Bibliografia
- ^ Rapoport S., Luebering J. Glycerate-2,3-diphosphatase. J Biol Chem 1951;189(2):683-694.
- ^ Rapoport S., Luebering J. The formation of 2,3-diphosphoglycerate in rabbit erythrocytes: the existence of a diphosphoglycerate mutase. J Biol Chem 1950;183(2):507-516.
- ^ a b c d e Cho J., King J.S., Qian X., Harwood A.J., Shears S.B. Dephosphorylation of 2,3-bisphosphoglycerate by MIPP expands the regulatory capacity of the Rapoport-Luebering glycolytic shunt. Proc Natl Acad Sci U S A 2008;105(16):5998-6003. doi:10.1073/pnas.0710980105
- ^ a b c DiMauro S., Miranda A.F., Khan S., Gitlin K., Friedman R. Human muscle phosphoglycerate mutase deficiency: newly discovered metabolic myopathy. Science 1981;212(4500):1277-9. doi:10.1126/science.6262916
- ^ a b c d Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 6th Edition. W.H. Freeman and Company, 2012.
- ^ a b c d Voet D. and Voet J.D. Biochemistry. 4th Edition. John Wiley J. & Sons, Inc. 2011.
- ^ Aljahdali A.S., Musayev F.N., Burgner J.W. 2nd, Ghatge M.S., Shekar V., Zhang Y., Omar A.M., Safo M.K. Molecular insight into 2-phosphoglycolate activation of the phosphatase activity of bisphosphoglycerate mutase. Acta Crystallogr D Struct Biol 2022;78(Pt 4):472-482. doi:10.1107/S2059798322001802
- ^ a b Moran L.A., Horton H.R., Scrimgeour K.G., Perry M.D. Principles of Biochemistry. 5th Edition. Pearson, 2012.
- ^ Reynolds C.H. Activation of human erythrocyte 2,3-bisphosphoglycerate phosphatase at physiological concentrations of substrate. Arch Biochem Biophys 1986;250(1):106-11. doi:10.1016/0003-9861(86)90706-x
- ^ Lemarchandel V., Joulin V., Valentin C., Rosa R., Galactéros F., Rosa J., Cohen-Solal M. Compound heterozygosity in a complete erythrocyte bisphosphoglycerate mutase deficiency. Blood 1992;80(10):2643-9. doi:10.1182/blood.V80.10.2643.2643
- ^ Sasaki R., Chiba H. Role and induction of 2,3-bisphosphoglycerate synthase. Mol Cell Biochem 1983;53-54(1-2):247-56. doi:10.1007/BF00225257
- ^ a b Garrett R.H., Grisham C.M. Biochemistry. 4th Edition. Brooks/Cole, Cengage Learning, 2010.
- ^ Oslund R.C., Su X., Haugbro M., Kee J-M., Esposito M., David Y., Wang B., Ge E., Perlman D.H., Kang Y., Muir T.W., Rabinowitz J.D. Bisphosphoglycerate mutase controls serine pathway flux via 3-phosphoglycerate. Nat Chem Biol 2017;13:1081-1087. doi:10.1038/nchembio.2453
- ^ Hodgkins S.R. 6 – Erythrocyte metabolism and membrane structure and function. Editor(s): Keohane E.M., Otto C.N., Walenga J.M. Rodak’s Hematology (Sixth Edition), Elsevier. 2020:78-90. doi:10.1016/B978-0-323-53045-3.00015-5
- ^ Orphanet: hemolytic anemia due to red cell pyruvate kinase deficiency. https://www.orpha.net/en/disease/detail/766
- ^ Orphanet: non-spherocytic hemolytic anemia due to hexokinase deficiency. https://www.orpha.net/en/disease/detail/90031
- ^ Paglia D.E., Shende A., Lanzkowsky P., Valentine W.N. Hexokinase “New Hyde Park”: a low activity erythrocyte isozyme in a Chinese kindred. Am J Hematol 1981;10(2):107-17. doi:10.1002/ajh.2830100202
- ^ Enegela O.A., Anjum F. Pyruvate Kinase Deficiency. [Updated 2023 Apr 27]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK560581/