Gli amminoacidi chetogenici sono amminoacidi il cui scheletro carbonioso può essere catabolizzato per intero o almeno in parte ad acetoacetil-CoA o acetil-CoA, molecole che possono essere utilizzate come precursori per la sintesi dei corpi chetonici, da cui il nome, o degli acidi grassi.[1]
Gli amminoacidi sono i costituenti fondamentali delle proteine. Una volta che il loro pool disponibile è sufficiente a soddisfare le necessità della sintesi proteica, non disponendo l’organismo di riserve specifiche di amminoacidi paragonabili a quelle del glicogeno per il glucosio o dei trigliceridi per gli acidi grassi, ne converte l’eccesso in intermedi del ciclo dell’acido citrico, impiegandoli nella produzione di energia.[2]
Quando il fabbisogno energetico cellulare è stato soddisfatto, i residui carboniosi derivanti dalla catabolismo amminoacidico vengono reindirizzati verso la sintesi del glucosio, degli acidi grassi, o dei corpi chetonici.[3]
Gli amminoacidi proteinogenici possono essere classificati come amminoacidi chetogenici o amminoacidi glucogenici sulla base del destino metabolico del loro scheletro carbonioso.[4] Lo scheletro carbonioso degli amminoacidi chetogenici viene catabolizzato ad acetoacetil-CoA e/o acetil-CoA, mentre quello degli amminoacidi glucogenici in uno o più dei seguenti cinque metaboliti precursori glucogenici: piruvato, ossalacetato, α-chetoglutarato, succinil-CoA e fumarato.[5]
Questa modalità di classificazione non è però univoca in quanto cinque amminoacidi sono sia chetogenici che glucogenici, poiché dal loro catabolismo si origina almeno un precursore glucogenico e uno chetogenico.[6]
Indice
- Quali sono gli amminoacidi chetogenici?
- Basi biochimiche
- Amminoacidi chetogenici nel digiuno prolungato
- Ciclo del gliossilato
- Bibliografia
Quali sono gli amminoacidi chetogenici?
Solamente due dei venti amminoacidi che compongono le proteine sono esclusivamente chetogenici: la leucina e la lisina. Dal catabolismo del loro scheletro carbonioso si origina acetoacetil-CoA e acetil-CoA.[6]
| Amminoacido | Catabolita | ||
| chetogenico | glucogenico | ||
| Fenilalanina | Acetoacetil-CoA | Fumarato | |
| Isoleucina | Acetil-CoA | Succinil-CoA | |
| Leucina * | Acetil-CoA | Acetoacetil-CoA | |
| Lisina * | Acetoacetil-CoA | ||
| Tirosina | Acetoacetil-CoA | Fumarato | |
| Treonina | Acetil-CoA | Succinil-CoA | |
| Triptofano | Acetil-CoA | Acetoacetil-CoA | Piruvato |
| * Amminoacidi esclusivamente chetogenici | |||
Altri cinque amminoacidi, ossia isoleucina, fenilalanina, treonina, triptofano, e tirosina, sono invece sia chetogenici che glucogenici in quanto il catabolismo dello scheletro carbonioso porta alla formazione di acetil-CoA e/o acetoacetil-CoA e un precursore glucogenico.[5]
L’utilizzo degli scheletri carboniosi degli amminoacidi è preceduto dalla rimozione del gruppo amminico. Alanina e glutammato, amminoacidi glucogenici, svolgono un ruolo chiave nel trasporto dei gruppi amminici dai tessuti extraepatici al fegato. In particolare, l’alanina viene trasportata dal muscolo e da altri tessuti periferici al fegato attraverso il ciclo glucosio-alanina.[7]
Basi biochimiche
Acetil-CoA e acetoacetil-CoA non sono precursori glucogenici. La spiegazione risiede nella stechiometria del ciclo dell’acido citrico e nell’incapacità degli animali di convertire l’acetil-CoA in piruvato.[8]
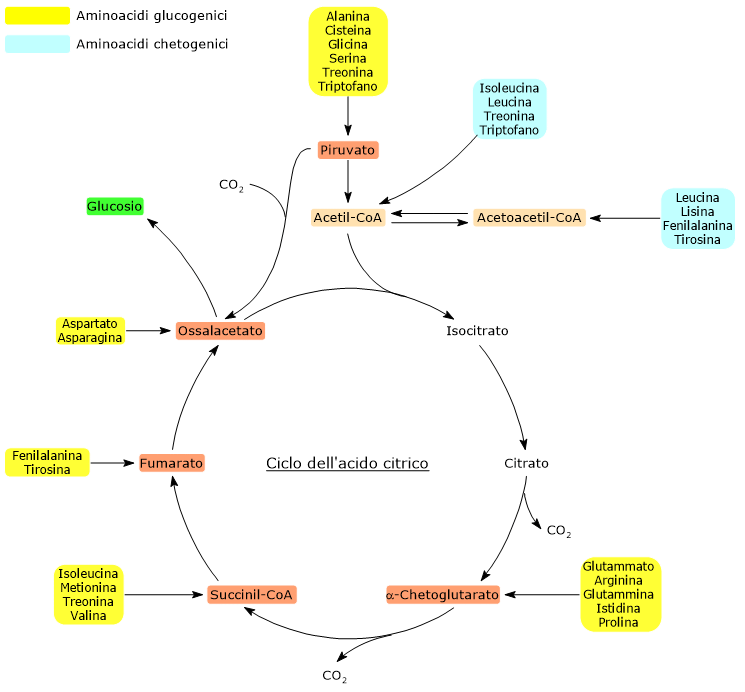
L’acetil-CoA entra nel ciclo dell’acido citrico a livello della reazione catalizzata dalla citrato sintasi (EC 2.3.3.1). L’enzima catalizza la condensazione dell’acetil-CoA con l’ossalacetato a formare il citrato. Dunque si passa da un composto a quattro atomi di carbonio a uno a sei atomi di carbonio, con un guadagno netto di due atomi carboni.
Tuttavia, nelle due successive decarbossilazioni ossidative del ciclo, catalizzate dalla isocitrico deidrogenasi (EC 1.1.1.42) e dal complesso multienzimatico dell’α-chetoglutarato deidrogenasi, sono perduti due atomi di carbonio.[4]
Quindi l’ingresso dell’acetil-CoA nel ciclo non comporta alcun guadagno netto di carbonio.[6]
La discriminante è quindi rappresentata dal punto d’ingresso delle unità carboniose a monte o a valle delle decarbossilazioni ossidative del ciclo dell’acido citrico.[8]
A tutto ciò va aggiunto che negli animali non esiste una via metabolica che permetta di produrre piruvato dall’acetil-CoA, data anche l’irreversibilità della reazione catalizzata dal complesso della piruvato deidrogenasi, la decarbossilazione ossidativa del piruvato ad acetil-CoA.[8]
Amminoacidi chetogenici nel digiuno prolungato
A differenza degli amminoacidi glucogenici, gli amminoacidi chetogenici non hanno un ruolo cruciale durante il digiuno prolungato o nelle diete con forte restrizione dei carboidrati.
Durante il digiuno prolungato, la principale fonte di acetil-CoA per la chetogenesi è la beta-ossidazione degli acidi grassi, mentre il contributo degli amminoacidi chetogenici è marginale. In queste condizioni, il ruolo centrale è svolto dagli amminoacidi glucogenici, che, attraverso la gluconeogenesi, garantiscono il mantenimento dell’omeostasi glicemica quando le riserve di glicogeno epatico sono esaurite.[5]
Ciclo del gliossilato
Piante, lieviti, e molti batteri possono utilizzare l’acetil-CoA per la sintesi del glucosio grazie alla via metabolica chiamata ciclo del gliossilato. Tale ciclo ha alcune reazioni in comune con il ciclo dell’acido citrico, due esclusive catalizzate dalla isocitrato liasi (EC 4.1.3.1) e malato sintasi (EC 2.3.3.9), ma non ha reazioni di decarbossilazione. Quindi gli organismi che possiedono il ciclo del gliossilato sono in grado di utilizzare gli acidi grassi e gli amminoacidi chetogenici per la sintesi del glucosio.[9]
Bibliografia
- ^ D’Andrea G. Classifying amino acids as gluco(glyco)genic, ketogenic, or both. Biochem Educ 2000;28(1):27-28. doi:10.1016/s0307-4412(98)00271-4
- ^ Brosnan J.T. Interorgan amino acid transport and its regulation. J Nutr 2003;133(6 Suppl 1):2068S-2072S. doi:10.1093/jn/133.6.2068S
- ^ Litwack G. Human biochemistry. 2nd Edition. Academic Pr, 2021.
- ^ a b Moran L.A., Horton H.R., Scrimgeour K.G., Perry M.D. Principles of Biochemistry. 5th Edition. Pearson, 2012.
- ^ a b c Rosenthal M.D., Glew R.H. Medical Biochemistry – Human Metabolism in Health and Disease. John Wiley J. & Sons, Inc., 2009.
- ^ a b c Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 6th Edition. W.H. Freeman and Company, 2012.
- ^ Felig P., Pozefsk T., Marlis E., Cahill G.F. Alanine: key role in gluconeogenesis. Science 1970;167(3920):1003-1004. doi:10.1126/science.167.3920.1003
- ^ a b c Voet D. and Voet J.D. Biochemistry. 4th Edition. John Wiley J. & Sons, Inc. 2011.
- ^ Kondrashov F.A., Koonin E.V., Morgunov I.G., Finogenova T.V., Kondrashova M.N. Evolution of glyoxylate cycle enzymes in Metazoa: evidence of multiple horizontal transfer events and pseudogene formation. Biol Direct 2006;1:31. doi:10.1186/1745-6150-1-31