La lipolisi è definita come la via biochimica responsabile dell’idrolisi dei triacilgliceroli, anche detti trigliceridi (TAG), ad acidi grassi non esterificati e glicerolo.
Gli enzimi coinvolti sono detti lipasi.
L’essenzialità della lipolisi deriva dal fatto che i trigliceridi come tali non sono in grado ne di entrare nelle cellule, come dimostrato per primo da Whitehead nel 1909, ne di uscirne. E nei vertebrati esistono tre processi, di seguito elencati, in cui la loro idrolisi è indispensabile per il normale assorbimento o rilascio degli acidi grassi e del glicerolo che li costituiscono, e dunque per l’omeostasi lipidica ed energetica.
- La lipolisi gastrointestinale è responsabile del catabolismo e successivo assorbimento dei trigliceridi derivanti dalla dieta.
Gli enzimi coinvolti sono la lipasi linguale, gastrica e pancreatica, e le PLRP1, 2 e 3. - La lipolisi vascolare porta all’idrolisi dei trigliceridi associati alle lipoproteine plasmatiche nel letto capillare.
In questo caso si ha l’intervento della lipoprotein lipasi (LPL). - La lipolisi intracellulare è responsabile della scissione dei trigliceridi immagazzinati nelle goccioline lipidiche intracellulari.
L’idrolisi intracellulare dei trigliceridi coinvolge due tipi di lipasi: acide e neutre.
Le lipasi acide hanno un pH ottimale di azione compreso tra 4 e 5.
Sono le lipasi più importanti presenti nei lisosomi e possono idrolizzare sia i trigliceridi che gli esteri del colesterolo. Questi enzimi sono ritenuti agire primariamente sui lipidi associati alle lipoproteine, a seguito della loro endocitosi recettore-mediata e fusione con i lisosomi. Tuttavia la loro azione è stata associata anche alla macroautofagia, una processo lisosomiale che degrada gli organelli danneggiati o superflui e le inclusioni citoplasmatiche, come aggregati di proteine mal ripiegate, rilasciando in seguito nel citosol i prodotti di idrolisi.
Le lipasi neutre citosoliche, hanno un pH ottimale d’azione di circa 7.
Comprendono:
la triacilglicerolo lipasi adipocitaria o lipasi del trigliceride (ATGL);
la lipasi ormono-sensibile o HSL (EC 3.1.1.79);
la monoacilglicerolo lipasi (MGL).
Nella restante parte dell’articolo sarà presa in esame la lipolisi intracellulare a opera delle lipasi neutre suddette e la sua regolazione ormonale e non ormonale, con particolare attenzione a quanto accade nel tessuto adiposo bianco.
Indice
- ATGL, HSL, MGL e lipolisi nel tessuto adiposo bianco
- Regolazione ormonale nel tessuto adiposo bianco
- Regolazione non ormonale nel tessuto adiposo bianco
- Lipolisi ATGL-mediata nei tessuti non adiposi
- Bibliografia
ATGL, HSL, MGL e lipolisi nel tessuto adiposo bianco
Gli acidi grassi depositati nel tessuto adiposo bianco in forma di trigliceridi rappresentano la più grande riserva di energia presente negli eucarioti superiori.
Quando la domanda di energia aumenta, come nel corso di attività fisiche intense e prolungate, si verifica l’idrolisi dei trigliceridi e la liberazione in circolo di acidi grassi.
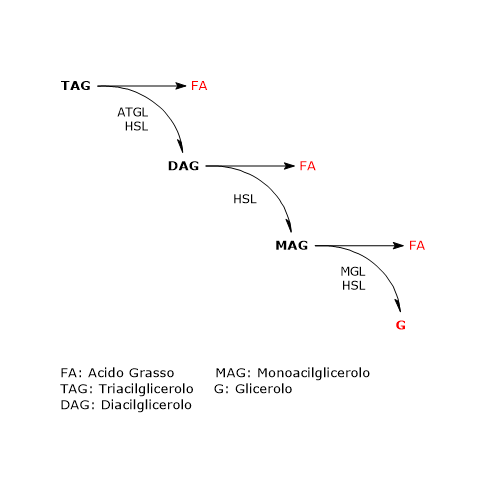
Nel tessuto adiposo bianco l’azione sequenziale di ATGL, HSL e MGL porta all’idrolisi completa dei trigliceridi. In questo processo, sia in vivo che in adipociti in coltura, ATGL e HSL sono responsabili di oltre il 90% dell’attività lipolitica.
Triacilglicerolo lipasi adipocitaria
Delle tre lipasi neutre ATGL è quella scoperta più di recente, essendo stata descritta per la prima volta nel 2004.
Il suo ruolo nel catabolismo dei trigliceridi è divenuto chiaro a seguito di studi condotti su topi mutanti privi dell’enzima, e su esseri umani con mutazioni a carico del gene che lo codifica. Negli uomini, ad esempio, si è osservato un accumulo sistemico di trigliceridi, dunque di massa grassa, e cardiomiopatia. Ciò indica chiaramente che l’attività dell’enzima è necessaria per ottenere una efficiente mobilizzazione dei trigliceridi nei tessuti adiposi e non adiposi.
L’enzima umano, codificato da un gene posto sul cromosoma 11p15.5, appartiene alla famiglia delle proteine contenenti un dominio patatina, tra cui si ritrovano 9 membri umani e 8 murini. Il dominio patatina, presente nella metà N-terminale della proteina che contiene anche il sito attivo, è stato inizialmente scoperto nelle idrolasi lipidiche della patata e altre piante, e prende il nome dalla proteina più abbondante presente nel tubero della patata, appunto patatina. La metà C-terminale ha invece principalmente funzione regolatoria, e comprende anche la regione idrofobica responsabile per il legame alle goccioline lipidiche, essenziale per l’attività dell’enzima in vivo.
Enzimi ortologhi sono presenti essenzialmente in tutte le specie eucariote, inclusi invertebrati, vertebrati, nonché funghi e piante.
L’enzima catalizza il primo passaggio dell’idrolisi dei trigliceridi, portando alla formazione di diacilgliceroli, anche detti digliceridi o DAG, e acidi grassi:
Trigliceride + H20 → Diacilglicerolo + Acido grasso
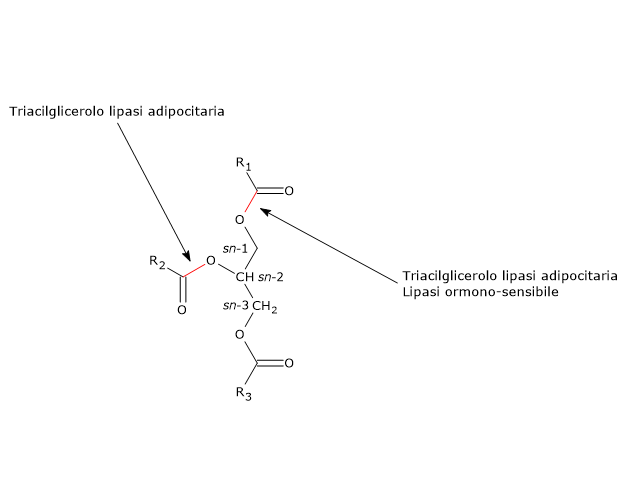
La proteina idrolizza di preferenza i legami estere in posizione sn-2, ma in presenza di CGI-58 la selettività si amplia anche al legame sn-1.
Dunque ATGL ha un ruolo centrale nel metabolismo, come suggerito anche da quanto accadde in topi geneticamente privi della proteina tenuti a digiuno, nei quali la carenza di acidi grassi liberi determina un massivo consumo di glucosio a scopi energetici, e in caso di digiuno oltre le 6 ore comparsa di ipoglicemia, ipometabolismo e ipotermia.
Se confrontata all’attività nei riguardi dei triacilgliceroli, quella espressa nei confronti dei diacilgliceroli, monoacilgliceroli, anche detti monogliceridi (MAG), esteri del colesterolo e del retinolo, appare minore o assente.
L’attività dell’enzima è soggetta a regolazione da parte di proteine inibitorie e stimolatorie, alcune delle quali sono localizzate sulle goccioline lipidiche. Di seguito ne sono descritte alcune.
CGI-58
Al pari della lipasi pancreatica e di LPL, che per raggiungere la massima efficienza catalitica necessitano di coattivatori proteici, anche ATGL richiede per la completa attività idrolitica la presenza di una proteina detta CGI-58 che va a stimolare la prima reazione della lipolisi intracellulare.
CGI-58 è una proteina altamente conservata tra le specie, nell’uomo codificata da un gene localizzato sul cromosoma 3p21, che va a interagire con il dominio patatina di ATGL. La massima stimolazione dell’enzima si ottiene quando le due proteine sono presenti in concentrazioni equimolari.
L’importanza di CGI-58 è sottolineata dal fatto che la sua deficienza o il suo malfunzionamento porta a un accumulo sistemico di trigliceridi sia negli uomini che nei topi.
La proteina è regolata principalmente attraverso la sua interazione con la perilipina-1 che riveste le goccioline lipidiche. CGI-58, almeno in vitro, agisce anche come acilglicerolo-3-fosfato aciltransferasi acil-CoA dipendente.
G0S2
E’ una proteina che inibisce l’attività di ATGL, identificata per la prima volta nelle cellule mononucleate del sangue, dove agisce nella transizione tra le fasi G0 e G1 del ciclo cellulare, e per questo chiamata G0S2.
Nell’uomo è codificata da un gene localizzato sul cromosoma 1q32.2.
La proteina è presente in molti tessuti. La concentrazione maggiore si ritrova nel tessuto adiposo e nel fegato, seguiti dal muscolo, ovaio e rene. All’interno della cellula è presente in diverse localizzazioni, come il citoplasma, i mitocondri, il reticolo endoplasmatico e le goccioline lipidiche. Probabilmente le diverse localizzazioni cellulari riflettono le varie funzioni che svolge, come la regolazione di:
- lipolisi;
- ciclo cellulare;
- forse dell’apoptosi, attraverso la sua capacita di interagire con il fattore mitocondriale antiapoptotico Bcl2.
G0S2, al pari di CGI-58, interagisce con il dominio patatina di ATGL, e, almeno in vitro, il legame alle goccioline lipidiche e l’inibizione dell’enzima dipendono dall’interazione fisica tra la sua regione N-terminale e il dominio patatina dell’enzima. Tuttavia non sembra che tale interazione sia in diretta competizione con il legame dell’attivatore CGI-58.
PEDF
Un’altra proteina coinvolta nella regolazione dell’attività di ATGL sembra essere PEDF che induce l’idrolisi dei trigliceridi nel tessuto adiposo, fegato e muscolo attraverso l’azione della lipasi.
E’ una proteina ampiamente espressa, appartenente alla famiglia delle Serpine non inibitorie, con un ampio spettro di attività, come effetti antiinfiammatori, antiossidativi, neuroprotettivi, antitumorali e antiangiogenici. La proteina si lega all’enzima e lo attiva. La sua attività può essere coinvolta nella patogenesi dell’insulino-resistenza e nello sviluppo della epatosteatosi.
Infine sembra che il trasporto di ATGL alle goccioline lipidiche richieda il trasporto vescicolare. Infatti in assenza di componenti proteici essenziali del macchinario di trasporto, quali le proteine SAR1, ARF1 o GBF1, la traslocazione dell’enzima alle goccioline lipidiche è bloccata, e l’enzima stesso rimane associato al reticolo endoplasmatico, da cui si ritiene gemmino le goccioline lipidiche.
Lipasi ormono-sensibile
Nei primi anni sessanta dello scorso secolo fu notato che l’attività lipolitica presente nel tessuto adiposo era indotta ormonalmente. E nel 1964 furono caratterizzate sia la lipasi ormono-sensibile che la monoacilglicerolo lipasi del tessuto adiposo.
Da subito fu chiaro che HSL era molto più efficiente nell’idrolizzare sia i digliceridi che i trigliceridi, in vitro di un fattore 10. Nonostante ciò fu assunto che HSL fosse l’enzima limitante per il catabolismo dei trigliceridi del tessuto adiposo e di molti altri tessuti non adiposi. Ma nel 2000 è stato osservato che topi privi dell’enzima non mostravano segni di accumulo di trigliceridi, sia nel tessuto adiposo che in altri tessuti, mentre accumulavano grandi quantità di diacilgliceroli in molti tessuti. Ciò ha suggerito che HSL sia molto più importante come diacilglicerolo idrolasi che non come triacilglicerolo idrolasi, fatto che oggi è comunemente accettato.
Diacilglicerolo + H20 → Monoacilglicerolo + Acido grasso
Tuttavia si tratta di un enzima multifunzionale in grado di idrolizzare, oltre ai diacilgliceroli, nei quali ha una stereo-preferenza per i legami estere in posizione sn-3, e triacilgliceroli, dove invece di preferenza idrolizza il legami estere in posizione sn-1, anche i legami estere di altri lipidi, come i monoacilgliceroli, o gli esteri del colesterolo e del retinolo.
L’enzima è codificato da un gene localizzato sul cromosoma 19q13.2. Lo splicing alternativo del gene porta a notevoli differenze nella regione 5’ del trascritto, e quindi a mRNA tessuto specifici e proteine di dimensioni differenti.
Il profilo di espressione dell’enzima ricalca essenzialmente quello di ATGL. Le concentrazioni più alte di mRNA e proteina sono presenti nel tessuto adiposo bianco e bruno; in molti altri tessuti e cellule, tra cui il muscolo, le cellule beta del pancreas, le cellule steroidogeniche, e i macrofagi l’espressione del gene è assai più bassa.
A differenza della triacilglicerolo lipasi adipocitaria, che presenta enzimi ortologi in tutti gli eucarioti, la lipasi ormono-sensibile è filogeneticamente meno ubiquitaria. Ad esempio, non ci sono proteine ortologhe note negli uccelli, in D. melanogaster, C. elegans o S. cerevisiae.
Infine, a differenza di quanto osservato con la ATGL, nell’uomo non sono state trovate mutazioni nel gene per l’enzima.
Nella struttura della proteina sono stati individuati.
- Un dominio N-terminale, che è ritenuto mediare la dimerizzazione dell’enzima, il suo legame ai lipidi, e l’interazione con FABP4, proteina che anche in vitro ne incrementa l’attività catalitica.
- Un dominio C-terminale, che contiene una struttura comune a molte esterasi e lipasi, detta dominio alfa/beta idrolasico che include la triade catalitica classica delle idrolasi umane (Ser424, Asp693, e His72), dunque il sito attivo.
- Un’ultima regione che costituisce il modulo regolatorio, localizzato all’interno del dominio catalitico dove sono presenti tutti e 5 i siti di fosforilazione noti, su altrettanti residui di serina, di cui due, Ser650 e Ser663, sembrano essere particolarmente importanti per l’attività idrolitica.
Monoacilglicerolo lipasi
La proteina è considerata l’enzima limitante per il catabolismo dei monoacilgliceroli derivanti dall’idrolisi dei:
- trigliceridi delle lipoproteine plasmatiche operata dalle lipoprotein lipasi;
- trigliceridi intracellulari a opera di ATGL e HSL;
- dei fosfolipidi intracellulari per azione della fosfolipasi C e delle diacilglicerolo lipasi alfa e beta associate alla membrana.
Monoacilglicerolo + H20 → Acido grasso + Glicerolo
Nell’uomo l’enzima è codificato da un gene presente sul cromosoma 3q21.3, ed è espresso in modo ubiquitario, con i livelli più alti nel tessuto adiposo, ma alti livelli anche negli epatociti e nelle cellule muscolari.
La proteina si trova localizzata sulle membrane cellulari, nel citoplasma e sulle goccioline lipidiche.
L’importanza della sua azione per una efficiente degradazione dei monoacilgliceroli è stata confermata da studi condotti su topi mutanti: la sua mancanza danneggia la lipolisi, ed è associata con un aumento dei livelli dei monoacilgliceroli in egual misura sia nel tessuto adiposo che nei tessuti non adiposi.
Altri enzimi che hanno attività monoacilglicerolo idrolasica sono HSL e ABHD6, per cui non è chiaro se in vivo la sua attività sia l’unica rilevante.
La proteina condivide omologie con esterasi, lisofosfolipasi, e aloperossidasi.
Sembra che ne la concentrazione dell’mRNA ne l’attività catalitica siano regolate ormonalmente o in base alla carica energetica cellulare.
Regolazione ormonale nel tessuto adiposo bianco
L’idrolisi dei trigliceridi nel tessuto adiposo bianco è regolata principalmente a livello post-trascrizionale attraverso processi di fosforilazione, interazioni proteina-proteina, e traslocazione delle proteine coinvolte.
Stimolazione beta-adrenergica
Adrenalina e glucagone, a seguito del legame agli specifici recettori beta-adrenergici presenti sugli adipociti, attivano ATGL e HSL, che andranno a idrolizzare in modo coordinato i trigliceridi.
Un ruolo centrale nel processo che porterà all’attivazione di ATGL e HSL è svolto dalla perilipina-1, una proteina associata alle goccioline lipidiche, e presente solamente in cellule che possono essere stimolate beta-adrenergicamente. A seguito di tale stimolazione, la perilipina-1 viene fosforilata su sei residui di serina dalla protein chinasi A (PKA).
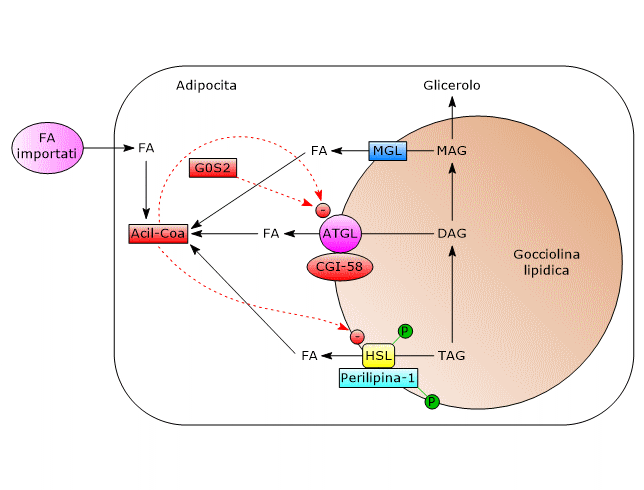
- ATGL
Negli adipociti non stimolati, CGI-58 è localizzata sulla superficie delle goccioline lipidiche, per la maggior parte legata alla perilipina-1, e non interagisce con ATGL. In queste condizioni l’attività dell’enzima è bassa e la lipolisi è modesta.
La fosforilazione della perilipina-1 porta al rilascio di CGI-58 che, in un modo ancora da chiarire, attiva ATGL.
Anche ATGL può essere fosforilata, su almeno due residui di serina, Ser404 e Ser428, ma non da PKA. Tuttavia, l’importanza di queste fosforilazioni nella regolazione dell’enzima non è ancora chiara. - HSL
Nel tessuto adiposo l’attività dell’enzima è fortemente indotta dalla stimolazione beta-adrenergica.
La fosforilazione aumenta moderatamente, di circa due volte, l’attività dell’enzima. Per la completa attivazione, HSL deve avere accesso alle goccioline lipidiche, cosa che nel tessuto adiposo è mediata dalla perilipina-1 fosforilata. In che modo?
Allo stato basale la perilipina-1 non è fosforilata e previene il legame di HSL alle goccioline lipidiche. Le fosforilazioni permettono il legame di HSL alla perilipina-1, in particolare alla regione N-terminale della proteina, e l’accesso alle goccioline lipidiche.
Quindi, la stimolazione beta-adrenergica, portando alla fosforilazione di HSL e alla sua traslocazione mediata dalla perilipina-1 sulle goccioline lipidiche, determina un incremento della sua attività nel tessuto adiposo bianco di circa 100 volte.
Altre chinasi, come AMPK o Ca2+/calmodulina chinasi sono in grado di fosforilare l’enzima modulandone l’attività. - CGI-58
La stimolazione β-adrenergica, come il digiuno, hanno un basso effetto sull’espressione della proteina nel tessuto adiposo.
Insulina e inibizione della lipolisi
L’insulina media la disattivazione della lipolisi intervenendo a livello trascrizionale, sull’attività degli enzimi, e a livello del sistema nervoso centrale.
- L’ormone causa la down-regolazione trascrizionale dell’espressione dei geni per ATGL e HSL.
- Determina la fosforilazione e attivazione di varie isoforme delle fosfodiesterasi da parte di PKB/AKT, l’idrolisi del cAMP per azione delle suddette fosfodiesterasi, la conseguente inattivazione di PKA, e quindi il blocco della lipolisi attraverso la prevenzione della fosforilazione sia di HSL che della perilipina-1.
- L’ormone inibisce la lipolisi anche attraverso un meccanismo centrale che chiama in causa il sistema nervoso simpatico. Infatti un aumento dei suoi livelli nel cervello inibisce la fosforilazione della lipasi ormono-sensibile e della perilipina-1.
Inoltre l’insulina stimola anche l’espressione di G0G2.
Regolazione non ormonale nel tessuto adiposo bianco
Nel processo di regolazione della lipolisi possono intervenire anche fattori non ormonali.
- Lavori recenti hanno messo in evidenza un’azione inibente sull’attività di ATGL da apate degli acil-CoA a catena lunga, come quelli che legano residui di acido palmitico e acido oleico, due acidi grassi molto abbondanti nel tessuto adiposo bianco.
Similmente a quanto già osservato per HSL, gli acil-CoA a catena lunga esercitano una inibizione non competitiva. Tale inibizione potrebbe rappresentare un meccanismo a feed-back per il controllo dell’idrolisi dei trigliceridi e la protezione della cellula da concentrazioni eccessive di molecole lipotossiche come ceramidi, diacilglicerolo e acil-CoA. - La proteina RIP-140, a seguito di un aumento del contenuto lipidico della cellula, induce la lipolisi attraverso il legame alla perilipina-1. Grazie a questo legame infatti la perilipina-1 sarà in grado di reclutare con più efficienza HSL sulla superficie delle goccioline lipidiche, come anche di incrementare la formazione di complessi tra ATGL e il suo attivatore CGI-58.
Lipolisi ATGL-mediata nei tessuti non adiposi
ATGL e HSL sono espressi anche nella maggior parte dei tessuti non adiposi , sebbene in bassi livelli. Ciò ha sollevato la questione se si verifichi l’intervento anche di altre lipasi per assicurare una lipolisi efficiente. Se ad esempio si considera il fegato di topi tenuti a digiuno, ATGL è responsabile per meno del 50% dell’idrolisi neutra dei trigliceridi, attività che è comunque importante poiché la sua assenza porta allo sviluppo di epatosteatosi. Ma anche in sua assenza, nell’epatocita rimane una buona attività idrolitica sui trigliceridi, che consente una normale produzione di VLDL, il cui assemblaggio e secrezione richiede una sostanziale mobilizzazione delle riserve di trigliceridi epatici.
In ogni modo, in tessuti non adiposi, come il muscolo scheletrico, cardiaco, e il fegato la lipolisi ATGL-mediata segue un meccanismo differente. La perilipina-1 è sostituita dalla perilipina-5. Nel digiuno la perilipina-5 recluta sia l’enzima che CGI-58 sulle gocciole lipidiche attraverso il legame diretto dell’enzima e del coattivatore. Quale sia il ruolo della perilipina-5 in questo complesso non è ancora chiaro, ma sembra che sia coinvolta nell’interazione delle goccioline lipidiche con i mitocondri e inibisca l’idrolisi dei trigliceridi mediata dall’enzima.
Nel muscolo scheletrico, la lipasi ormono-sensibile è attivata mediante fosforilazione in risposta all’adrenalina e alla contrazione muscolare.
Nei tessuti non adiposi che mancano della perilipina-1 il ruolo di HSL è meno bene caratterizzato e l’espressione dell’enzima è piuttosto bassa. L’interazione tra HSL e le goccioline lipidiche potrebbe essere coinvolgere la perilipina-2 e la perilipina-5.
Bibliografia
- Boeszoermenyi A., Nagy H.M., Arthanari A., Pillip C.J., Lindermuth H., Eulogio Luna R., Wagner G., Zechner R., Zangger K., and Oberer M. Structure of a CGI-58 motif provides the molecular basis of lipid droplet anchoring. J Biol Chem 2015;290(44):26361-26372. doi:10.1074/jbc.M115.682203
- Ho P.C., Chuang Y.S., Hung C.H., and Wei L.N. Cytoplasmic receptor-interacting protein 140 (RIP140) interacts with perilipin to regulate lipolysis. Cell Signal 2011;23:1396-1403. doi:10.1016/j.cellsig.2011.03.023
- Lass A., Zimmermann R., Oberer M., Zechner R. Lipolysis – A highly regulated multi-enzyme complex mediates the catabolism of cellular fat stores. Prog Lipid Res 2011;50;14-27. doi:10.1016/j.plipres.2010.10.004
- Nagy H.M., Paar M., Heier C., Moustafa T., Hofer P., Haemmerle G., Lass A., Zechner R., Oberer M., Zimmermann R. Adipose triglyceride lipase activity is inhibited by long-chain acyl-coenzyme A. Biochim Biophys Acta 2014;1841:588-594. doi:10.1016/j.bbalip.2014.01.005
- Zechner R., Zimmermann R., Eichmann T.O., Kohlwein S.D., Haemmerle G., Lass A., and Madeo F. FAT SIGNALS – Lipases and lipolysis in lipid metabolism and signaling. Cell Metab 2012;15:279-291. doi:10.1016/j.cmet.2011.12.018