Il fenomeno per cui due o più composti chimici differenti presentano la stessa formula molecolare è chiamato isomeria, dal greco isos che significa uguale e meros che significa parte, concetto e termine introdotti dallo scienziato svedese Jacob Berzelius nel 1830.[3][4]
L’isomeria è conseguenza del fatto che gli atomi presenti in una stessa formula molecolare possono unirsi in diversi modi a dare composti, detti isomeri, che posseggono proprietà fisiche e chimiche differenti.
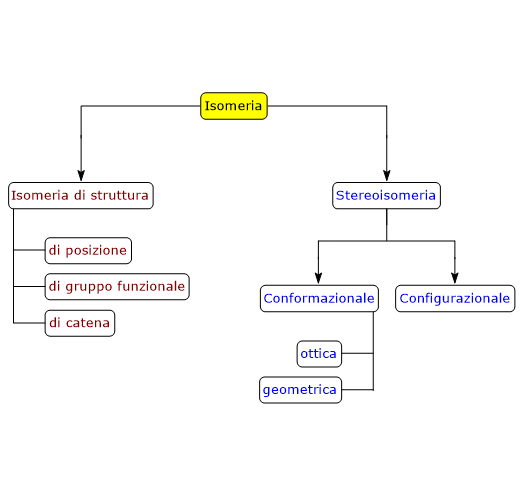
L’isomeria può essere di due tipi: isomeria di struttura e stereoisomeria, a loro volta suddividibili in ulteriori sottotipi.[1]
Indice
Isomeria di struttura
Nella isomeria di struttura, anche detta strutturale o di costituzione, gli isomeri differiscono tra di loro in quanto gli atomi costituenti sono legati in modi e sequenze differenti.
Esistono diversi sottotipi di isomeria di struttura: l’isomeria di posizione, di gruppo funzionale e di catena.
Isomeri di posizione
Nella isomeria di posizione o posizionale gli isomeri hanno gli stessi gruppi funzionali ma disposti in posizioni diverse sulla stessa catena carboniosa.
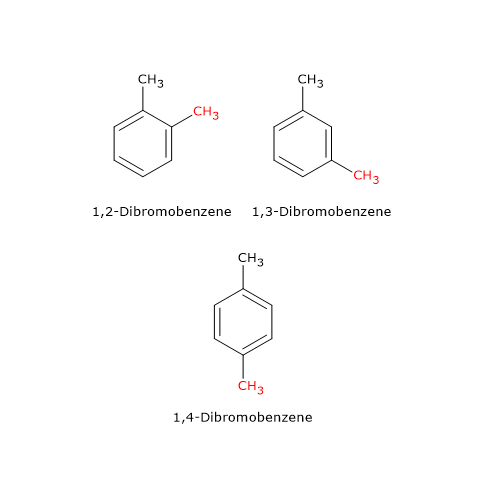
Un esempio è il composto di formula molecolare C6H4Br2, di cui esistono tre isomeri: l’1,2-dibromobenzene, l’1,3-dibromobenzene e l’1,4-dibromobenzene. I tre isomeri differiscono per la posizione degli atomi di bromo sulla struttura ciclica.
Un altro esempio è il composto di formula molecolare C3H8O, di cui esistono due isomeri: 1-propanolo o alcol n-propilico, e il 2-propanolo o alcol isopropilico. Questi isomeri differiscono per la posizione del gruppo ossidrilico lungo la catena carboniosa.
Isomeri di gruppo funzionale
Nella isomeria di gruppo funzionale, anche detta isomeria funzionale, gli atomi sono organizzati in modo da dare luogo alla formazione di gruppi funzionali diversi.
Un esempio è il composto di formula molecolare C2H6O, di cui esistono due isomeri: il dimetiletere o etere dimetilico e l’etanolo o etil alcool, che presentano gruppi funzionali diversi, un gruppo etere, –O–, e un gruppo ossidrilico, –OH.
Isomeri di catena
Nella isomeria di catena gli isomeri differiscono nella disposizione delle catene carboniose, che possono essere ramificate o lineari.
Un esempio è il composto di formula molecolare C5H12, di cui esistono tre isomeri: l’n-pentano, il 2-metilbutano o isopentano e il 2,2-dimetilpropano o neopentano.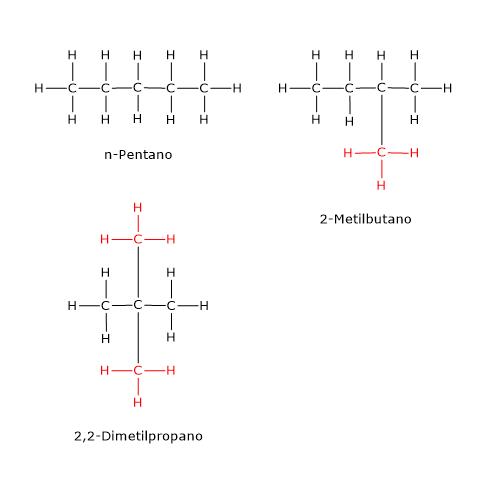 Esempi di isomeria di catena si hanno anche tra lipidi. Ad esempio, nel gruppo degli acidi grassi a catena corta risultano isomeri di catena l’acido butirrico e l’acido isobutirrico, che hanno formula molecolare C4H8O2, e l’acido valerico, l’acido isovalerico e l’acido 2-metilbutirrico, che hanno formula molecolare C5H10O2.
Esempi di isomeria di catena si hanno anche tra lipidi. Ad esempio, nel gruppo degli acidi grassi a catena corta risultano isomeri di catena l’acido butirrico e l’acido isobutirrico, che hanno formula molecolare C4H8O2, e l’acido valerico, l’acido isovalerico e l’acido 2-metilbutirrico, che hanno formula molecolare C5H10O2.
Stereoisomeria
Nella stereoisomeria gli isomeri hanno lo stesso numero e tipo di atomi e legami ma differiscono nella orientazione degli atomi nello spazio.[3][4] Questi isomeri sono detti stereoisomeri, dal greco stereos che significa “solido”.
La stereoisomeria può essere di due tipi: isomeria conformazionale e isomeria configurazionale. Quest’ultima è suddividibile in due ulteriori sottotipi, l’isomeria ottica e l’isomeria geometrica.
Isomeria conformazionale
Nella isomeria conformazionale gli stereoisomeri possono essere interconvertiti tra a seguito di rotazioni attorno a uno o più legami singoli, i legami σ. Queste rotazioni producono disposizioni differenti degli atomi nello spazio che non sono sovrapponibili. Inoltre, il numero delle possibili conformazioni che una molecola può assumere è in teoria infinito, variando dalla struttura a più bassa energia, la più stabile, a quella a più alta energia, la meno stabile. Ciascun isomero è definito conformero.
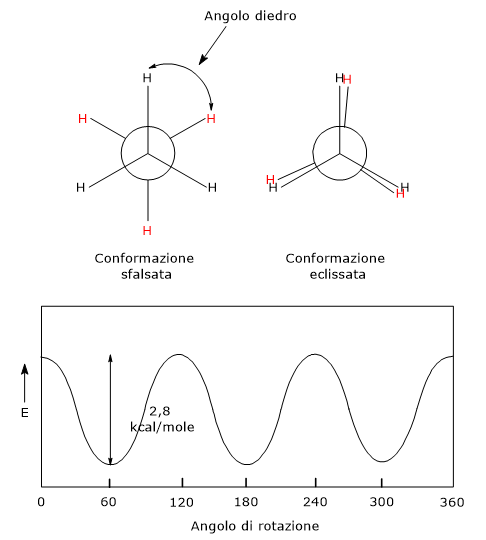
Se ad esempio si considera l’etano, di formula molecolare C2H4, guardando la molecola da una estremità lungo la direzione del legame carbonio-carbonio, gli atomi di idrogeno di un gruppo metilico possono trovarsi rispetto agli atomi di idrogeno dell’altro gruppo metilico in una delle seguenti conformazioni.
- In conformazione eclissata, nella quale gli atomi di idrogeno di un gruppo metilico sono nascosti da quelli dell’altro gruppo metilico, quindi l’angolo tra i legami carbonio-idrogeno tra i carboni anteriori e posteriori, detto angolo diedro, può essere 0, 120, 240 o 360 gradi. Questa è la conformazione a più alta energia, dunque la meno stabile.
- In conformazione sfalsata, nella quale gli atomi di idrogeno di un gruppo metilico sono completamente sfalsati rispetto a quelli dell’altro gruppo metilico, quindi l’angolo diedro può essere 60, 180 o 300 gradi. Questa è la conformazione a più bassa energia, quindi la più stabile.
- In conformazioni sgembe, che corrispondono a una qualsiasi delle conformazioni intermedie tra le due precedenti.
La maggiore o minore stabilità dei conformeri dipende dal grado di sovrapposizione delle coppie di elettroni dei legami carbonio-idrogeno dei due gruppi metilici:
- nella conformazione sfalsata la distanza è la massima possibile;
- nella conformazione eclissata le coppie elettroniche sono alla distanza minima possibile.
La barriera di energia potenziale tra le due conformazioni opposte è piccola, circa 2,8 kcal/mole (11,7 kJ/mole). A temperatura ambiente l’energia cinetica posseduta dalle molecole è di 15-20 kcal/mole (62,7-83,6 kJ/mole), più che sufficiente a permettere la libera rotazione attorno al legame carbonio-carbonio. Di conseguenza non è possibile isolare i singoli conformeri dell’etano.
Nota: considerando il doppio legame carbonio-carbonio, la barriera di energia potenziale che si oppone alla libera rotazione attorno al doppio legame è di circa 63 kcal/mole (264 kJ/mole), e corrisponde all’energia necessaria per rompere il legame π (Vedi isomeria geometrica). Questa quantità di energia è circa tre volte l’energia cinetica posseduta dalle molecole a temperatura ambiente, alla quale quindi la libera rotazione è impedita. Solamente a temperature superiori ai 300° le molecole acquistano un’energia termica sufficiente a rompere il legame π, permettendo così la libera rotazione intorno al legame σ rimanente, e quindi l’interconversione tra gli isomeri cis e trans.
Isomeria configurazionale
Nella isomeria configurazionale l’interconversione tra gli isomeri non avviene a seguito di rotazioni attorno a legami singoli ma comporta la rottura di legami e la formazione di nuovi legami, quindi a temperatura ambiente non avviene spontaneamente.
Esistono due sottotipi di isomeria configurazionale: l’isomeria ottica e l’isomeria geometrica.
Isomeri ottici
L’isomeria ottica è caratteristica delle molecole che hanno uno o più centri di chiralità o centri chirali, ossia un atomo tetraedrico che leghi quattro ligandi differenti.[2] Il centro chirale può essere un atomo di carbonio, fosforo, zolfo o azoto.
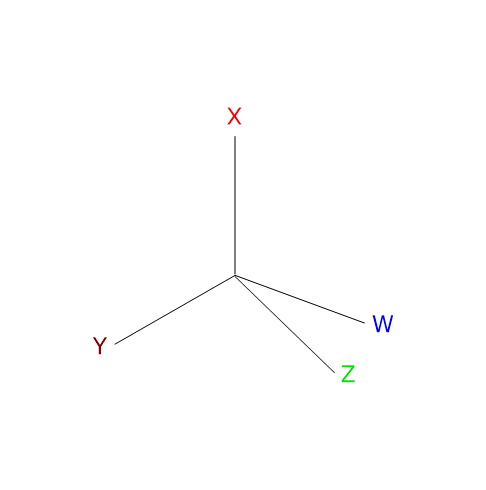
Nota: la parola chiralità deriva dal greco cheiros che significa “mano”.
Gli isomeri ottici mancano di un centro di simmetria o di un piano di simmetria, sono immagini speculari gli uni degli altri, e non sono sovrapponibili. Questi stereoisomeri sono detti enantiomeri, dal greco enántios che significa “contrario”.
A differenza degli altri isomeri, due enantiomeri hanno identiche proprietà fisiche e chimiche con due sole eccezioni.
- La direzione di rotazione del piano della luce polarizzata, da cui il nome di isomeria ottica.
Se una soluzione di un enantiomero ruota il piano della luce polarizzata in senso orario, l’enantiomero viene indicato con il simbolo (+). Di contro, una soluzione dell’altro enantiomero ruota il piano della luce polarizzata in senso antiorario dello stesso angolo, e l’enantiomero è indicato con il simbolo (-). - Sebbene spesso indistinguibili dalla maggior parte delle tecniche, due enantiomeri possono essere distinti in un ambiente chirale, come il sito attivo di enzimi chirali.
Si noti che per una molecola con n centri chirali esiste un numero massimo di stereoisomeri pari a 2n.
Isomeri geometrici
L’isomeria geometrica, anche detta isomeria cis-trans, è caratteristica delle molecole dove non è possibile la libera rotazione tra due atomi per la presenza di strutture rigide come:
- i composti con doppi legami carbonio-carbonio, carbonio-azoto o azoto-azoto, dove la rigidità è dovuta al doppio legame;
- i composti ciclici, dove la rigidità è dovuta alla presenza dell’anello.
Un esempio di isomeria geometrica dovuta a un doppio legame carbonio-carbonio si ha con lo stilbene, composto di formula molecolare C14H12, di cui esistono due isomeri. In uno, definito isomero cis, i gruppi uguali sono dalla stessa parte rispetto al piano individuato dal doppio legame, mentre nell’altro, detto isomero trans, i gruppi uguali sono da parti opposte.
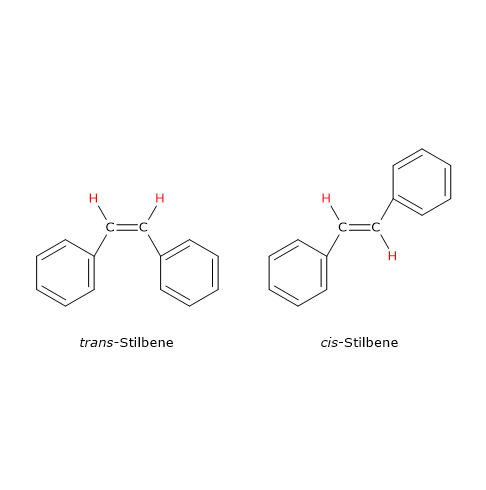
Nota: i termini trans e cis derivano dal latino trans che significa “al di la”, e cis che significa “di qua”.
Tra i composti ciclici, l’isomeria cis-trans non complicata dalla presenza di centri chirali si osserva nei sistemi con numero pari di atomi di carbonio e sostituiti in posizioni opposte, ossia para-sostituiti. Un esempio è l’1,4-dimetilcicloesano, un cicloalcano, idrocarburi ciclici di formula generale CnH2n,, di cui esistono due stereoisomeri, il cis-1,4-dimetilcicloesano e il trans-1,4-dimetilcicloesano.
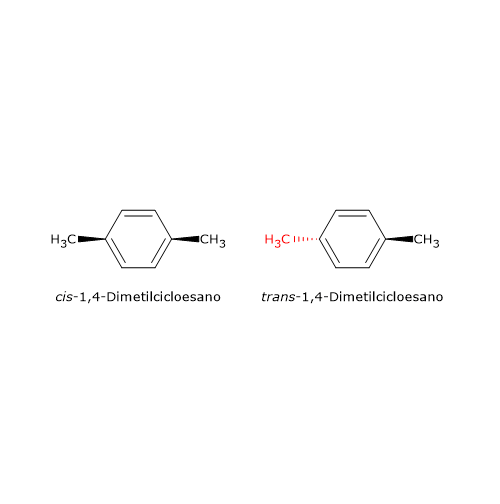
Questo tipo di stereoisomeria non può esistere nel caso in cui uno dei due atomi non liberi di ruotare leghi due gruppi identici. Perché? Per passare dallo stereoisomero cis a quello trans è necessario scambiare tra di loro i due gruppi legati a uno dei due atomi impegnati nel doppio legame. Se i due gruppi sono uguali lo scambio porta alla formazione della stessa molecola.
Nota: gli isomeri geometrici sono un caso particolare di diastereomeri o diastereoisomeri, che, a loro volta, sono stereoisomeri che non sono l’uno l’immagine speculare dell’altro. Gli altri diastereomeri sono i composti meso e gli isomeri ottici non enantiomerici.
Bibliografia
- ^ Graham Solomons T. W., Fryhle C.B., Snyder S.A. Solomons’ organic chemistry. 12th Edition. John Wiley & Sons Incorporated, 2017
- ^ Kelvin WT. Baltimore lectures on molecular dynamics and the wave theory of light. Clay C. J., London: 1904:619. https://archive.org/details/baltimorelecture00kelviala/mode/2
- ^ a b Morris D.G. Stereochemistry. Royal Society of Chemistry, 2001. doi:10.1039/9781847551948
- ^ a b North M. Principles and applications of stereochemistry. 1th Edition. CRC Press, 1998