Il 2,3-bisfosfoglicerato (2,3-BPG) è la base coniugata dell’acido 2,3-bisfosfoglicerico.[10]
Nel globulo rosso, a livello del mare, è presente in concentrazioni vicine a quella dell’emoglobina (Hb), circa 5 mM. Negli altri tipi cellulari è invece presente in tracce.[18]
Nell’eritrocita viene sintetizzato a partire dall’1,3-bisfosfoglicerato (1,3-BPG) nella prima reazione dello shunt di Rapoport-Luebering.[16][17] Essendo lo shunt di Rapoport-Luebering una deviazione dalla via glicolitica a monte delle reazioni che portano alla sintesi dell’ATP, la produzione di 2,3-bisfosfoglicerato comporta un costo energetico di due molecole di ATP per molecola prodotta.[11]
Il 2,3-BPG ed è uno dei regolatori dell’affinità dell’emoglobina per l’ossigeno.[4] E’ inoltre necessario all’attività catalitica della fosfoglicerato mutasi (EC 5.4.2.1), ed è un attivatore allosterico della ribosio fosfato pirofosfochinasi (EC 2.7.6.1).[14][18]
Legandosi all’emoglobina ne riduce l’affinità per l’ossigeno facilitandone il rilascio a livello dei tessuti periferici.[4]
Nel globulo rosso la concentrazione del 2,3-bisfosfoglicerato può variare in risposta a modifiche nel flusso di carbonio attraverso la via glicolitica. Tali modificazioni possono essere conseguenti a variazioni di altitudine, a malattie che compromettano l’ossigenazione del sangue, o difetti a carico di enzimi glicolitici, e si riflettono sull’affinità di legame tra emoglobina e ossigeno.[3][15][19]
Indice
- Proprietà chimiche
- Metabolismo
- Ruolo del 2,3-bisfosfoglicerato
- Emoglobina
- 2,3-Bisfosfoglicerato ed emoglobina-A
- 2,3-Bisfosfoglicerato ed emoglobina F
- Variazioni della concentrazione del 2,3-bisfosfoglicerato
- Bibliografia
Proprietà chimiche
Il 2,3-bisfosfoglicerato è la base coniugata dell’acido 2,3-bisfosfoglicerico. Ha un peso molecolare di 261,00 g/mol e formula molecolare C3H3O10P2-5.[10]
Secondo la nomenclatura IUPAC il suo nome è (2R)-2,3-bis(fosfonoossi)propanoato.[6]
Il pKa dell’acido 2,3-bisfosfoglicerico è pari a 0,48. Ne consegue che a pH fisiologico è presente quasi esclusivamente in forma ionizzata, il 2,3-BPG.[6]
E’ solubile in acqua, con un valore pari a 9,69 g/L.[10]
Il 2,3-bisfosfoglicerato è un isomero dell’1,3-bisfosfoglicerato.
Metabolismo
Il 2,3-bisfosfoglicerato viene prodotto a partire dall’intermedio glicolitico 1,3-bisfofoglicerato nella prima delle due tappe che compongono lo shunt di Rapoport-Luering.[16][17]
Entrambe le reazioni dello shunt sono catalizzate dalla bisfosfoglicerato mutasi (EC 5.4.2.4), enzima multifunzionale in grado di svolgere tre attività principali, potendo agire come 2,3-BPG sintasi, l’attività principale, 2,3-BPG fosfatasi, e 2,3-BPG mutasi.[1]
Nella prima reazione dello shunt di Rapoport-Luebering l’enzima agisce come sintasi e catalizza l’isomerizzazione dell’1,3-bisfosfoglicerato a 2,3-bisfosfoglicerato. L’enzima catalizza il trasferimento intermolecolare di un gruppo fosforico dal C-1 dell’1,3-bisfosfoglicerato al C-2 del 3-fosfoglicerato, che quindi deve essere presente nel sito attivo. La reazione comporta la conversione del 3-fosfoglicerato a 2,3-bisfosfoglicerato mentre l’1,3-BPG diviene il nuovo 3-fosfoglicerato.[4]
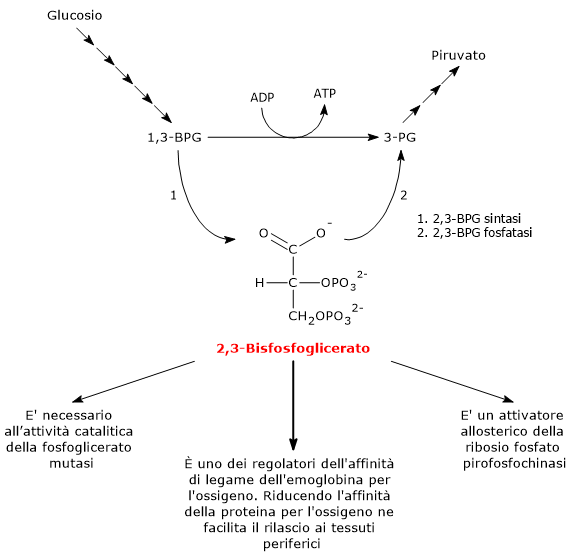 Nella seconda reazione dello shunt, il 2,3-bisfosfoglicerato viene defosforilato a 3-fosfoglicerato. La reazione è catalizzata dall’attività fosfatasica della bisfosfoglicerato mutasi. Il 3-fosfoglicerato rientra quindi nella via glicolitica a livello dell’ottava tappa, catalizzata dalla fosfoglicerato mutasi (EC 5.4.2.1).[11]
Nella seconda reazione dello shunt, il 2,3-bisfosfoglicerato viene defosforilato a 3-fosfoglicerato. La reazione è catalizzata dall’attività fosfatasica della bisfosfoglicerato mutasi. Il 3-fosfoglicerato rientra quindi nella via glicolitica a livello dell’ottava tappa, catalizzata dalla fosfoglicerato mutasi (EC 5.4.2.1).[11]
Costo energetico della sintesi del 2,3-bisfosfoglicerato
La sintesi del 2,3-bisfosfoglicerato comporta un costo energetico per il globulo rosso pari a due molecole di ATP per molecola prodotta.[11]
L’1,3-BPG è il substrato della settima reazione della glicolisi, il trasferimento catalizzato dalla fosfoglicerato chinasi (EC 2.7.2.3) del gruppo fosforico ad alta energia legato al C-1 all’ADP, con formazione di 3-fosfoglicerato e ATP. La fosfoglicerato chinasi catalizza infatti la prima delle due fosforilazioni a livello del substrato che, lungo la via glicolitica, portano alla conservazione di parte dell’energia chimica presente nel glucosio in forma di ATP, la moneta di scambio energetico della cellula.[4]
Dato che, in condizioni fisiologiche, lo shunt di Rapoport-Luebering intercetta circa il 20% del flusso glicolitico, il costo energetico pagato dal globulo rosso per la sintesi del 2,3-bisfosfoglicerato implica l’esistenza di un equilibrio finemente regolato tra il fabbisogno energetico della cellula e la necessità di mantenere l’emoglobina in un adeguato stato di deossigenazione e ossigenazione.[7][9]
Ruolo del 2,3-bisfosfoglicerato
Il 2,3-bisfosfoglicerato svolge almeno tre funzioni.
- E’ necessario per l’attività catalitica della fosfoglicerato mutasi. Ne consegue che la molecola ha anche un ruolo nel controllo del livello degli intermedi glicolitici.[14]
- E’ uno degli attivatori allosterici della ribosio fosfato pirofosfochinasi o PRPP sintetasi. L’enzima catalizza l’attivazione del ribosio-5-fosfato, uno dei due prodotti della via del pentoso fosfato, a 5-fosforibosil-1-pirofosfato (PRPP), intermedio nella sintesi de novo delle purine.[18]
- Il 2,3-bisfosfoglicerato è coinvolto, assieme ad altri fattori, nella regolazione allosterica dell’affinità dell’emoglobina per l’ossigeno, concorrendo a regolarne il rilascio a livello dei tessuti periferici.[8] Nell’uomo, nella maggior parte dei primati e in molti altri mammiferi il 2,3-bisfosfoglicerato riduce l’affinità dell’emoglobina per l’ossigeno. In questo modo la molecola favorisce la dissociazione dell’ossigeno dall’emoglobina, facilitandone la cessione ai tessuti.[4] L’azione del 2,3-BPG è un esempio di regolazione allosterica eterotropica, ossia un regolazione allosterica in cui l’effettore è diverso dal normale ligando della proteina.[11]
Emoglobina
L’emoglobina è presente nei globuli rossi, e, in quasi tutti i vertebrati, ha il compito di trasportare l’ossigeno molecolare ai tessuti.
La proteina ha una struttura quaternaria formata da quattro subunità e contiene quattro gruppi prostetici eme, uno per subunità, ognuno dei quali in grado di legare, reversibilmente, una molecola di ossigeno.[9]
In condizioni fisiologiche nell’uomo si distinguono due tipi di emoglobina: quella presente nell’adulto, indicata come emoglobina A, e quella fetale, l’emoglobina F.
L’emoglobina A è formata da due catene α, di 141 residui amminoacidici, e due catene β, di 146 residui amminoacidici. Dunque è un tetramero α2β2.
Nell’emoglobina F le catene β sono sostituite da catene γ, molto simili, ma non identiche alle β. Ne risulta un tetramero α2γ2.[9] Questa differenza ha una grande influenza sull’affinità della proteina per l’ossigeno.[11]
L’emoglobina può esistere in due conformazioni indicate come stato T, teso, e stato R, rilassato.
Sebbene l’ossigeno si leghi all’emoglobina sia nello stato T che in quello R, ha un’affinità maggiore per lo stato R, che viene stabilizzato dal legame. Il legame dell’ossigeno da parte dell’emoglobina è modulato da diversi fattori, alcuni con azione a breve termine e altri, come il 2,3-bisfosfoglicerato, che agiscono più a lungo termine.[4]
Cooperatività del legame emoglobina-ossigeno
L’emoglobina nello stato deossigenato si trova in conformazione T.
Il legame dell’ossigeno all’emoglobina nello stato T può avvenire solo sul gruppo eme di una delle subunità α, essendo i gruppi eme delle subunità β nello stato T virtualmente inaccessibili.[4]
Il legame della prima molecola di ossigeno innesca una variazione conformazionale nella subunità α che la converte nello stato R. Tale modifica è trasmessa alle subunità adiacenti mediante interazioni subunità-subunità, modifica che determina il passaggio della seconda subunità α allo stato R. Ciò innesca cambiamenti conformazionali sequenziali che portano al passaggio della struttura quaternaria dell’emoglobina che lega due molecole di ossigeno, Hb:(O2)2, dallo stato T a quello R.
A questo punto anche le subunità β possono legare l’ossigeno.[4]
Questo tipo di legame è detto cooperativo ed è alla base dell’andamento sigmoidale della curva di saturazione dell’emoglobina.[5]
Affinità dell’emoglobina per l’ossigeno
Nei capillari polmonari l’ossigeno si lega all’emoglobina, e, a mezzo della circolazione sanguigna, raggiunge i tessuti periferici cui viene rilasciato.
L’affinità di legame tra emoglobina e ossigeno è determinata principalmente dalla struttura dell’emoglobina. Tuttavia risulta modulata da vari fattori quali:
- temperatura;
- pH;
- anidride carbonica (CO2);
- ioni cloro (Cl⁻);
- 2,3-bisfosfoglicerato.[8]
Le modifiche nell’affinità del legame Hb-O2 che si verificano nel sistema circolatorio ad opera dei suddetti fattori sono tali da ottimizzare il carico di ossigeno a livello polmonare e la sua cessione nei tessuti periferici.[19]
Graficamente, le modifiche dell’affinità di legame indotte dagli effettori allosterici e dalla temperatura, si traducono in spostamenti della curva di saturazione dell’emoglobina verso destra, nel caso di una diminuzione dell’affinità di legame, o verso sinistra, quando l’affinità di legame aumenta.[11]
Temperatura, pH, e CO2 operano un regolazione a breve termine.[19] Se ad esempio si considera il muscolo scheletrico durante l’esercizio fisico, vi si osserva un aumento della temperatura, della concentrazione degli ioni idrogeno e della pressione parziale della CO2. Alte concentrazioni di H⁺ e CO2 riducono l’affinità dell’emoglobina per l’ossigeno, un effetto noto come effetto Bohr. Anche l’aumento della temperatura diminuisce l’affinità. Tutto ciò favorisce il rilascio di ossigeno al tessuto muscolare.[2]
Anche gli ioni cloro e il 2,3-bisfosfoglicerato riducono l’affinità dell’emoglobina per l’ossigeno, ma si associano a una regolazione più a lungo termine.[19]
2,3-Bisfosfoglicerato ed emoglobina A
Il 2,3-bisfosfoglicerato si va a legare all’emoglobina A a mezzo di legami ionici che si stabiliscono con residui delle catene β carichi positivamente.
I legami tra il 2,3-bisfosfoglicerato e l’emoglobina si stabiliscono con le catene laterali della lisina 82, istidina143, e il gruppo ammino-terminale di ciascuna della due catene β. Questi residui vanno a formare una tasca elettrostatica complementare sia alla conformazione che alla distribuzione di carica del 2,3-BPG.[11]
Il 2,3-BPG si lega all’emoglobina deossigenata e stabilizza lo stato T. Anche gli ioni idrogeno, cloro e l’anidride carbonica stabilizzano lo stato T.[19]
Nel passaggio dallo stato T a quello R, tra le varie modifiche conformazionali che occorrono nella struttura quaternaria dell’emoglobina, si verifica anche il restringimento della tasca di legame per 2,3-BPG tra le subunità β, impedendone quindi il legame.
Degno di nota è il fatto che mentre l’emoglobina ha quattro siti di legame per l’ossigeno molecolare, ne ha solo uno per il 2,3-BPG.[4] Inoltre, il sito di legame per il 2,3-BPG è lontano da quello per l’ossigeno.[11]
2,3-Bisfosfoglicerato ed emoglobina F
Le catene γ dell’emoglobina F, analogamente alle catene β dell’emoglobina A, vanno a formare la tasca di legame per il 2,3-BPG.[11]
Tuttavia, nella tasca di legame sono presenti due cariche positive in meno rispetto all’emoglobina A. Infatti, in posizione 143 delle catene γ l’istidina è sostituita da una serina.[18]
Questa piccola differenza nella struttura primaria fa si che il 2,3-bisfosfoglicerato si leghi con minor affinità, e di conseguenza che l’emoglobina F abbia un’affinità per l’ossigeno maggiore rispetto all’emoglobina materna. Ciò concorre ad assicurare il trasferimento dell’ossigeno dall’emoglobina A a quella F, quindi dalla circolazione materna a quella fetale.[4]
Variazioni della concentrazione del 2,3-bisfosfoglicerato
La concentrazione del 2,3-bisfosfoglicerato nel globulo rosso può essere influenzata da diversi fattori, sia fisiologici che patologici.[18]
Tra le condizioni fisiologiche c’è l’adattamento all’alta montagna, mentre tra le condizioni patologiche si hanno difetti genetici a carico di enzimi glicolitici sia a valle che a monte della reazione catalizzata dalla gliceraldeide-3-fosfato deidrogenasi (EC 1.2.1.12), o malattie che causano ipossia.[12][13]
In tutti i casi le variazioni sono conseguenti a modifiche nella sua velocità di sintesi, e si riflettono sull’affinità dell’emoglobina per l’ossigeno.
Adattamento all’alta montagna
L’adattamento all’alta montagna è un processo piuttosto complesso che comporta anche un aumento del numero dei globuli rossi e del loro contenuto in emoglobina. Queste modifiche richiedono, per completarsi, settimane. Tuttavia, già dopo un giorno di permanenza in alta quota viene percepito un certo grado di adattamento. Questo effetto è conseguenza dell’aumento della concentrazione eritrocitaria del 2,3-bisfosfoglicerato.[18]
Ciò che accade è che la bassa pressione parziale dell’ossigeno attiva la glicolisi. A sua volta questo comporta un aumento del flusso di carbonio attraverso lo shunt di Rapoport-Luebering con conseguente aumento della sintesi del 2,3-bisfosfoglicerato, la cui concentrazione che può arrivare sino a 8 mM.
Tale aumento determina una riduzione dell’affinità dell’emoglobina per l’ossigeno, che ne facilita il rilascio ai tessuti periferici, concorrendo così all’adattamento all’alta montagna.[11]
Anemia
Variazioni della concentrazione eritrocitaria del 2,3-bisfosfoglicerato si hanno anche in due malattie a trasmissione autosomica recessiva: l’anemia emolitica non sferocitica da deficit di esochinasi e l’anemia emolitica da deficit di piruvato chinasi negli eritrociti.[12][13]
Nell’anemia emolitica dovuta a un deficit di piruvato chinasi negli eritrociti (EC 2.7.1.40), la carenza dell’enzima causa un incremento della sintesi di 2,3-BPG e, di conseguenza, una riduzione dell’affinità dell’emoglobina per l’ossigeno.[3] Un incremento della concentrazione del 2,3-BPG si verifica anche nei soggetti affetti da condizioni che limitano l’ossigenazione del sangue, che causano cioè ipossia. Un esempio è l’insufficienza cardiopolmonare.[18]
Nell’anemia emolitica non sferocitica causata da un deficit di esochinasi (EC 2.7.1.1), il deficit enzimatico eritrocitario causa una riduzione della concentrazione del 2,3-bisfosfoglicerato, portando così a un aumento dell’affinità dell’emoglobina per l’ossigeno.[15]
Bibliografia
- ^ Aljahdali A.S., Musayev F.N., Burgner J.W. 2nd, Ghatge M.S., Shekar V., Zhang Y., Omar A.M., Safo M.K. Molecular insight into 2-phosphoglycolate activation of the phosphatase activity of bisphosphoglycerate mutase. Acta Crystallogr D Struct Biol 2022;78(Pt 4):472-482. doi:10.1107/S2059798322001802
- ^ Böning D., Schwiegart U., Tibes U., Hemmer B. Influences of exercise and endurance training on the oxygen dissociation curve of blood under in vivo and in vitro conditions. Eur J Appl Physiol Occup Physiol 1975;34(1):1-10. doi:10.1007/BF00999910
- ^ a b Enegela O.A., Anjum F. Pyruvate Kinase Deficiency. [Updated 2023 Apr 27]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK560581/
- ^ a b c d e f g h i Garrett R.H., Grisham C.M. Biochemistry. 4th Edition. Brooks/Cole, Cengage Learning, 2010.
- ^ Henry E.R., Bettati S., Hofrichter J., Eaton W.A. A tertiary two-state allosteric model for hemoglobin. Biophys Chem 2002;98(1-2):149-64. doi:10.1016/s0301-4622(02)00091-1
- ^ a b HMDB. Metabocard for 2,3-Diphosphoglyceric acid. https://hmdb.ca/metabolites/HMDB0001294
- ^ Hodgkins S.R. 6 – Erythrocyte metabolism and membrane structure and function. Editor(s): Keohane E.M., Otto C.N., Walenga J.M. Rodak’s Hematology (Sixth Edition), Elsevier. 2020:78-90. doi:10.1016/B978-0-323-53045-3.00015-5
- ^ a b Mairbäurl H., Oelz O., Bärtsch P. Interactions between Hb, Mg, DPG, ATP, and Cl determine the change in Hb-O2 affinity at high altitude. J Appl Physiol 1993;74(1):40-8. doi:10.1152/jappl.1993.74.1.40
- ^ a b c Moran L.A., Horton H.R., Scrimgeour K.G., Perry M.D. Principles of Biochemistry. 5th Edition. Pearson, 2012.
- ^ a b c National Center for Biotechnology Information. PubChem Compound Summary for CID 9548671, 2,3-Bisphosphoglycerate. https://pubchem.ncbi.nlm.nih.gov/compound/2_3-Bisphosphoglycerate. Accessed Feb. 16, 2025.
- ^ a b c d e f g h i Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 6th Edition. W.H. Freeman and Company, 2012.
- ^ a b Orphanet: hemolytic anemia due to red cell pyruvate kinase deficiency. https://www.orpha.net/en/disease/detail/766
- ^ a b Orphanet: non-spherocytic hemolytic anemia due to hexokinase deficiency. https://www.orpha.net/en/disease/detail/90031
- ^ a b Oslund R.C., Su X., Haugbro M., Kee J-M., Esposito M., David Y., Wang B., Ge E., Perlman D.H., Kang Y., Muir T.W., Rabinowitz J.D. Bisphosphoglycerate mutase controls serine pathway flux via 3-phosphoglycerate. Nat Chem Biol 2017;13:1081-1087. doi:10.1038/nchembio.2453
- ^ a b Paglia D.E., Shende A., Lanzkowsky P., Valentine W.N.. Hexokinase “New Hyde Park”: a low activity erythrocyte isozyme in a Chinese kindred. Am J Hematol 1981;10(2):107-17. doi:10.1002/ajh.2830100202
- ^ a b Rapoport S., Luebering J. Glycerate-2,3-diphosphatase. J Biol Chem 1951;189(2):683-694.
- ^ a b Rapoport S., Luebering J. The formation of 2,3-diphosphoglycerate in rabbit erythrocytes: the existence of a diphosphoglycerate mutase. J Biol Chem 1950;183(2):507-516.
- ^ a b c d e f g Voet D. and Voet J.D. Biochemistry. 4th Edition. John Wiley J. & Sons, Inc. 2011.
- ^ a b c d e Webb K.L., Dominelli P.B., Baker S.E., Klassen S.A., Joyner M.J., Senefeld J.W., Wiggins C.C. Influence of high hemoglobin-oxygen affinity on humans during hypoxia. Front Physiol 2022;12:763933. doi:10.3389/fphys.2021.763933