Sono definiti amminoacidi glucogenici quegli amminoacidi il cui scheletro carbonioso può essere catabolizzato in toto o in parte in precursori della sintesi del glucosio o gluconeogenesi, da cui il nome.[1]
Gli amminoacidi sono i mattoni costituenti le proteine. Quando il loro pool soddisfa le esigenze cellulari per la sintesi proteica, non esistendo nell’organismo depositi di amminoacidi analoghi al glicogeno per il glucosio o ai trigliceridi per gli acidi grassi, l’eccesso amminoacidico viene catabolizzato a precursori del ciclo dell’acido citrico e utilizzato per la produzione di energia.[2]
Tuttavia, nel momento in cui le esigenze energetiche della cellula sono soddisfatte, gli scheletri carboniosi derivanti dal catabolismo amminoacidico sono utilizzati per la sintesi di acidi grassi, corpi chetonici, o glucosio.[3]
Sulla base del destino metabolico dello scheletro carbonioso si individuano amminoacidi glucogenici e amminoacidi chetogenici. Tale classificazione non è però netta in quanto, dei venti amminoacidi standard che si ritrovano nelle proteine, cinque sono sia glucogenici che chetogenici.[4]
La sintesi del glucosio dagli amminoacidi glucogenici è resa possibile dal fatto che il loro scheletro carbonioso viene catabolizzato, per intero o in parte, in piruvato, ossalacetato, α-chetoglutarato, succinil-CoA, o fumarato.[5]
Piruvato e ossalacetato sono intermedi della gluconeogenesi, mentre l’ingresso degli altri tre metaboliti nel ciclo dell’acido citrico permette un guadagno netto di unità carboniose per il ciclo medesimo, unità che quindi potranno entrare nella gluconeogenesi come ossalacetato.[6]
Gli amminoacidi glucogenici sono particolarmente importanti nel digiuno prolungato, rappresentando una fonte rilevante di precursori per la gluconeogenesi, secondi solo al glicerolo derivante dalla lipolisi nel tessuto adiposo.[7]
Indice
- Quali sono gli amminoacidi glucogenici?
- Basi biochimiche
- Amminoacidi glucogenici nel digiuno prolungato
- Bibliografia
Quali sono gli amminoacidi glucogenici?
Dei venti amminoacidi costituenti le proteine tredici sono esclusivamente glucogenici, ossia dal catabolismo del loro scheletro carbonioso si originano solo precursori del glucosio.[4]
| Amminoacido | Catabolita | ||
| chetogenico | glucogenico | ||
| Alanina | Piruvato | ||
| Arginina | α-Chetoglutarato | ||
| Asparagina | Fumarato | ||
| Aspartato | Ossalacetato | ||
| Cisteina | Piruvato | ||
| Fenilalanina * | Acetoacetil-CoA | Fumarato | |
| Glicina | Piruvato | ||
| Glutammato | α-Chetoglutarato | ||
| Glutammina | α-Chetoglutarato | ||
| Isoleucina * | Acetil-CoA | Succinil-CoA | |
| Istidina | α-Chetoglutarato | ||
| Metionina | Succinil-CoA | ||
| Prolina | α-Chetoglutarato | ||
| Serina | Piruvato | ||
| Tirosina * | Acetoacetil-CoA | Fumarato | |
| Treonina * | Acetil-CoA | Succinil-CoA | |
| Triptofano * | Acetil-CoA | Acetoacetil-CoA | Piruvato |
| Valina | Succinil-CoA | ||
| * Amminoacidi sia glucogenici che chetogenici | |||
Cinque amminoacidi, ossia isoleucina, fenilalanina, treonina, triptofano, e tirosina, sono invece sia glucogenici che chetogenici in quanto parte del loro scheletro carbonioso viene catabolizzato a precursori glucogenici e parte ad acetil-CoA e/o acetoacetil-CoA.[8]
L’utilizzo degli scheletri carboniosi degli amminoacidi deve essere preceduto dalla rimozione del loro gruppo amminico. Alanina e glutammato, le principali molecole responsabili del trasporto dei gruppi amminici dai tessuti extraepatici al fegato, sono amminoacidi glucogenici particolarmente importanti nei mammiferi. L’alanina è il principale substrato gluconeogenetico per il fegato, e arriva all’organo dal muscolo e da altri tessuti periferici seguendo la via del ciclo glucosio-alanina.[9]
Basi biochimiche
Come con gli amminoacidi chetogenici, anche con gli amminoacidi glucogenici l’analisi della stechiometria del ciclo dell’acido citrico chiarisce perché il loro scheletro carbonioso sia un precursore per la sintesi del glucosio. La discriminante è rappresentata dal punto d’ingresso nel ciclo dell’acido citrico.[6]
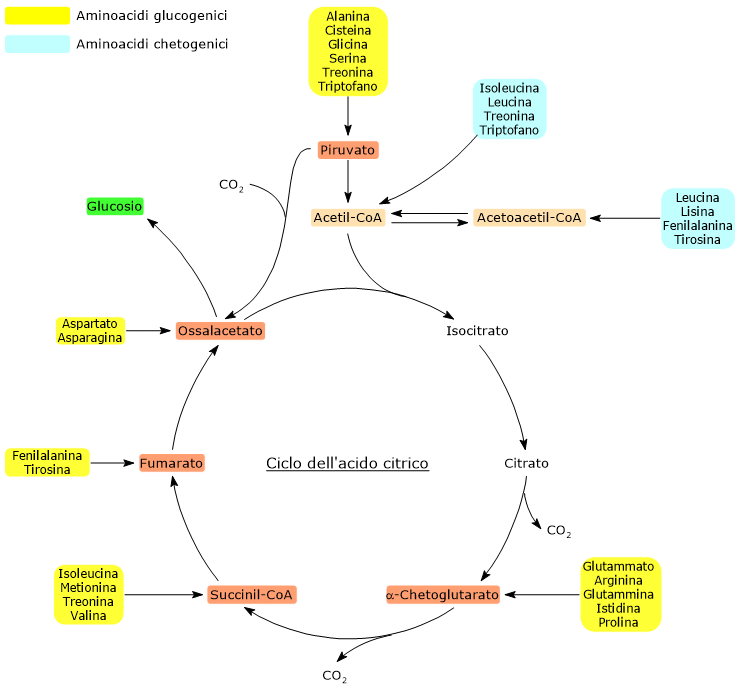
L’ingresso nel ciclo dei carboni di derivazione amminoacidica in forma di α-chetoglutarato, succinil-CoA, e fumarato comporta un guadagno netto di unità carboniose. Infatti, con l’esclusione dell’α-chetoglutarato, gli altri metaboliti vi entrano a valle delle due reazioni di decarbossilazione ossidativa catalizzate dalla isocitrico deidrogenasi (EC 1.1.1.42) e dal complesso multienzimatico dell’α-chetoglutarato deidrogenasi.[5]
Questo permette al ciclo un guadagno netto di un’unità carboniosa in caso di ingresso a livello dell’α-chetoglutarato, o due se l’ingresso avviene come succinil-CoA, e fumarato. Le unità carboniose potranno quindi entrare nella gluconeogenesi in forma di ossalacetato.[4]
Inoltre, anche l’irreversibilità della reazione catalizzata dal complesso della piruvato deidrogenasi, ossia la decarbossilazione ossidativa del piruvato ad acetil-CoA, e l’assenza negli animali di altre vie metaboliche che permettano la sintesi di piruvato dall’acetil-CoA, non permettono all’acetil-CoA di essere un substrato glucogenico.[6]
Amminoacidi glucogenici nel digiuno prolungato
Gli amminoacidi glucogenici sono particolarmente importanti nel digiuno prolungato e nelle diete con forte restrizione dell’apporto di carboidrati. In queste condizioni sono tra i più importanti precursori per la sintesi del glucosio.[6] L’utilizzo del loro scheletro carbonioso, assieme al glicerolo e al propionato, un acido grasso a catena corta, concorre infatti al mantenimento dell’omeostasi glicemica, via gluconeogenesi, quando le riserve epatiche di glicogeno sono esaurite.[7]
Tuttavia, anche in condizioni fisiologiche, ad esempio nel turn-over delle proteine cellulari, o a seguito di un pasto ricco in proteine, gli amminoacidi in eccesso rispetto alle necessità della sintesi proteica saranno catabolizzati e utilizzati, sulla base dello stato metabolico, a fini energetici o anabolici, per la sintesi del glucosio e di seguito per la glicogenosintesi, la sintesi dei corpi chetonici o degli acidi grassi, a seconda dell’amminoacido in questione.[2]
Bibliografia
- ^ D’Andrea G. Classifying amino acids as gluco(glyco)genic, ketogenic, or both. Biochem Educ 2000;28(1):27-28. doi:10.1016/s0307-4412(98)00271-4
- ^ a b Brosnan J.T. Interorgan amino acid transport and its regulation. J Nutr 2003;133(6 Suppl 1):2068S-2072S. doi:10.1093/jn/133.6.2068S
- ^ Litwack G. Human biochemistry. 2nd Edition. Academic Pr, 2021.
- ^ a b c Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 6th Edition. W.H. Freeman and Company, 2012.
- ^ a b Moran L.A., Horton H.R., Scrimgeour K.G., Perry M.D. Principles of Biochemistry. 5th Edition. Pearson, 2012.
- ^ a b c d Voet D. and Voet J.D. Biochemistry. 4th Edition. John Wiley J. & Sons, Inc. 2011.
- ^ a b Kuriyama H., Shimomura I., Kishida K., Kondo H., Furuyama N., Nishizawa H., Maeda N., Matsuda M., Nagaretani H., Kihara S., Nakamura T., Tochino Y., Funahashi T., Matsuzawa Y. Coordinated regulation of fat-specific and liver-specific glycerol channels, aquaporin adipose and aquaporin 9. Diabetes 2002;51(10):2915-2921. 10.2337/diabetes.51.10.2915
- ^ Rosenthal M.D., Glew R.H. Medical Biochemistry – Human Metabolism in Health and Disease. John Wiley J. & Sons, Inc., 2009.
- ^ Felig P., Pozefsk T., Marlis E., Cahill G.F. Alanine: key role in gluconeogenesis. Science 1970;167(3920):1003-1004. doi:10.1126/science.167.3920.1003