Il fruttosio è un monosaccaride a sei atomi di carbonio, dunque un esoso.
Fu scoperto dal chimico francese Dubrunfaut A-P. nel 1847, lo stesso che tre anni prima, nel 1844, per primo notò il fenomeno della mutarotazione, e, in seguito scoprì il disaccaride maltosio.[6] Nel 1857 il chimico inglese Miller W.A. coniò il termine fruttosio, dal latino fructus, che significa frutto, più il suffisso per gli zuccheri –ose.[17]
In soluzione può esistere in forma a catena aperta e in forma ciclica, nella quale sono possibili quattro stereoisomeri.[24]
Deriva quasi esclusivamente dalla dieta. E’ presente nella frutta e verdura, nel miele, e nel saccarosio, ma anche in prodotti di origine industriale come lo zucchero invertito o lo sciroppo di mais ad alto contenuto di fruttosio.[34] Gli animali sono anche in grado di sintetizzarlo a partire dal glucosio o dal sorbitolo attraverso la via dei polioli.[20]
Un’eccessiva assunzione di fruttosio può favorire l’insorgenza della gotta.[28]
Nell’uomo il fruttosio viene metabolizzato principalmente nel fegato attraverso una via detta fruttolisi, che porta alla formazione di trioso trioso fosfati che possono essere utilizzati sia a fini anabolici che catabolici.[30]
Sono conosciuti due errori congeniti del metabolismo del fruttosio: la fruttosuria essenziale e l’intolleranza ereditaria al fruttosio.[30][13]
Indice
- Proprietà chimiche
- Fonti alimentari
- Assorbimento intestinale
- Concentrazione ematica
- Fruttolisi epatica
- Fruttosio e gotta
- Sintesi endogena
- Errori congeniti del metabolismo del fruttosio
- Bibliografia
Proprietà chimiche
Al pari degli altri esosi ha formula molecolare C6H12O6 e peso molecolare di 180,16 g/mol.[18]
Può esistere come due enantiomeri, che, sulla base del sistema di nomenclatura detto convenzione di Fischer o sistema D-L, sono indicati come D-fruttosio e L-fruttosio. In Natura predomina la forma D, per cui di seguito con il termine fruttosio ci si riferirà a essa.
Come gli altri monosaccaridi, in soluzione può esistere in forma a catena aperta e in forma ciclica. Nella forma a catena aperta, che può essere rappresentata ricorrendo alle proiezioni di Fischer, il gruppo carbonilico in posizione 2 fa parte di un gruppo chetonico, per cui il monosaccaride è un chetoesoso, a differenza ad esempio del galattosio, glucosio, mannosio e ribosio che sono aldoesosi, in quanto il gruppo carbonilico fa parte di un’aldeide.
La presenza del gruppo carbonilico fa si che il fruttosio, al pari degli altri monosaccaridi, e del maltosio e lattosio tra i disaccaridi, sia uno zucchero riducente.[19]
E’ estremamente solubile in acqua, avendo, a 20 °C, una solubilità pari a 3750 g/L, e tra i monosaccaridi risulta il più solubile. La sua elevata solubilità è alla base della sua igroscopicità, ossia la capacità di assorbire l’acqua dall’atmosfera circostante, che a sua volta è la causa delle difficoltà incontrate nell’ottenerne la forma cristallina, nella quale si presenta in forma di cristalli bianchi. La forma cristallina è stata ottenuta, con metodi efficaci ed economici, solo di recente, da cui la successiva vendita nei negozi.[1]
Anomeri
L’anomeria è un tipo di isomeria ottica caratteristica dei monosaccaridi.
La forma a catena aperta è termodinamicamente instabile ed è presente solo in tracce a seguito della ciclizzazione conseguente all’attacco nucleofilo dell’atomo di ossigeno di uno dei gruppi ossidrilici al carbonio carbonilico. L’attacco nucleofilo porta alla formazione di un emichetale ciclico, mentre il precedente carbonio carbonilico, legando quattro ligandi differenti, diventa un centro di asimmetria, ossia un centro di chiralità, ed è chiamato carbonio emichetalico.[25]
Poichè l’attacco nucleofilo può avvenire sia dalla parte inferiore che superiore del piano sp2 del carbonio carbonilico, sarà possibile la formazione, a seconda del ossigeno ossidrilico che porta l’attacco nucleofilo, di quattro configurazioni differenti che differiscono nella configurazione del carbonio emichetalico. Questo fenomeno è detto mutarotazione, e porta alla formazione di due coppie di epimeri:
- due configurazioni piranosiche, il beta-D-fruttofuranosio, alfa-D-fruttofuranosio, ossia anelli a sei atomi costituiti da un atomo di ossigeno e cinque di carbonio;
- due configurazioni furanosiche, il beta-D-fruttopiranosio e l’alfa-D-fruttopiranosio, ossia anelli a cinque atomi costituiti da un atomo di ossigeno e quattro di carbonio.
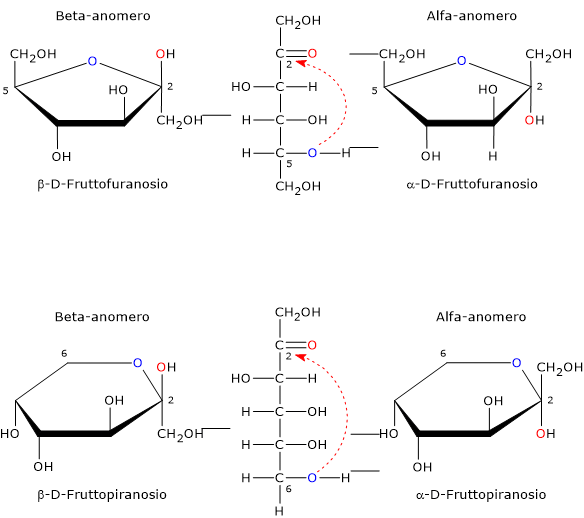
Differendo solo nella configurazione del carbonio emichetalico, tali epimeri sono detti anomeri, e sono indicati rispettivamente come anomero alfa e anomero beta, mentre il carbonio emichetalico è detto carbonio anomerico o centro anomerico.
Potere dolcificante
Il fruttosio è il più dolce fra gli zuccheri presenti in Natura, superato solo da alcuni additivi alimentari utilizzati come dolcificanti.[5] Tuttavia il suo potere dolcificante dipende dallo stato fisico in cui si trova, ossia se è in forma cristallina o disciolto in acqua e, in quest’ultimo caso, il potere dolcificante è funzione dalla temperatura dell’acqua. Alla base di queste differenza c’è la struttura ciclica prevalente.
In forma cristallina è presente solo il beta-D-fruttopiranosio, l’anomero a cui si deve la dolcezza del monosaccaride, che risulta due volte più dolce del saccarosio, un disaccaride formato da una molecola di alfa-D-glucosio, in forma piranosica, e una di beta-D-fruttosio, in forma furanosica.
Quando viene disciolto in soluzione, la sua dolcezza varia in funzione della temperatura. Infatti una volta disciolto, sono presenti i quattro possibili anomeri, di cui l’alfa-D-fruttopiranosio è presente solo in tracce.[24]
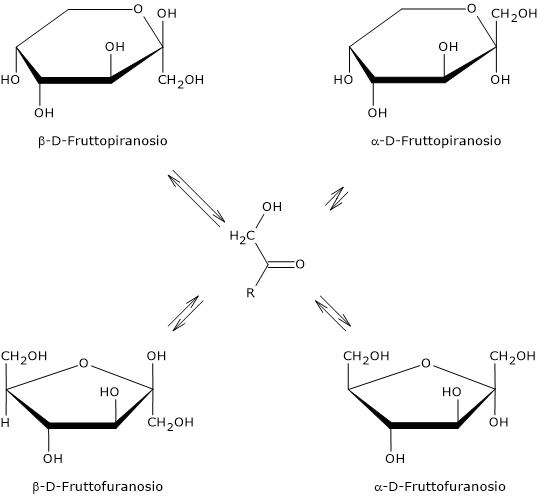
Se a 25 °C prevale il beta-D-fruttopiranosio, che rappresenta circa il 68% degli anomeri presenti, all’aumentare della temperatura la sua percentuale diminuisce e a 80 °C è scesa a circa il 50%. Quindi, considerando che le strutture furanosiche non sono dolci, all’aumentare della temperatura il potere dolcificante del fruttosio si riduce, e, ad esempio a 40 °C ha circa lo stesso potere dolcificante del saccarosio, mentre a 60 °C è circa il 20% meno dolce.
Fonti alimentari
Il fruttosio è un componente naturale della dieta dell’uomo, essendo presente nella frutta, dove può rappresentare fino al 5-8% del peso, e in quantità inferiori nelle verdure, specialmente le verdure tuberose come le cipolle e, in misura minore, le patate.[34]
Tra i frutti, l’uva, le mele e le pere ne contengono buone quantità, mentre la quantità più elevata si riscontra nei fichi secchi, anche a seguito della disidratazione e quindi concentrazione del monosaccaride, e nei succhi di mela e pera.
Per migliaia di anni, prima della modernizzazione e specializzazione nei metodi di lavorazione sia in ambito agricolo che della lavorazione dei cibi, gli esseri umani hanno assunto un quantitativo giornaliero di fruttosio compreso tra circa 16 e 24 grammi, derivante per la maggior parte dalla frutta e miele.[5]
Attualmente invece il suo consumo procapite è stimato oscillare tra gli 8 e i 100 grammi, con una media negli USA di circa 80 g. La maggior parte dell’aumento è ascrivibile al consumo di fruttosio proveniente da fonti differenti rispetto a frutta e verdura, quali:
- miele, dove arriva a costituire fino al 40% del peso del prodotto;
- succhi concentrati, ad esempio alcuni omogeneizzati di frutta, dove costituisce oltre il 60% del peso del prodotto;
- zucchero invertito, ossia una miscela equimolare di fruttosio e glucosio ottenuta dall’idrolisi del saccarosio;
- saccarosio;
- melassa, che è costituita per circa un 10% da fruttosio;
- sciroppo d’acero, che contiene circa il 63% in peso di saccarosio;
- sciroppo di mais ad alto contenuto di fruttosio o HFCS, dove il fruttosio arriva a costituire fino al 90% del peso del prodotto. HFCS è utilizzato dall’industria alimentare, ad esempio per addolcire le bevande.[34]
Con l’esclusione del saccarosio e degli alimenti e bevande che lo contengono, in tutti gli altri casi il fruttosio è presente in forma libera. Ovviamente, la fonte più ricca è rappresentata dal fruttosio in forma cristallina, utilizzato spesso direttamente come dolcificante.
Assorbimento intestinale
Nei mammiferi la digestione dei carboidrati avviene grazie all’azione di specifiche idrolasi, quali le disaccaridasi presenti nella membrana dell’orletto a spazzola degli enterociti e la alfa-amilasi pancreatica, enzimi in grado di idrolizzare i legami glicosidici dei disaccaridi, oligosaccaridi e polisaccaridi liberando i monosaccaridi costituenti.[23]
Il fruttosio in forma libera presente nell’intestino tenue può derivare dall’idrolisi del saccarosio o essere ingerito come tale.
L’assorbimento dei monosaccaridi avviene a livello della membrana apicale degli enterociti dell’intestino tenue, dove il loro passaggio all’interno della cellula è mediato da specifiche proteine transmembrana che fungono da trasportatori. I trasportatori per il fruttosio appartengono alla famiglia GLUT, acronimo di glucose transporter, proteine che permettono la diffusione facilitata dei monosaccaridi attraverso la membrana plasmatica. Nei mammiferi la famiglia GLUT si compone di 14 membri, suddivisi in tre classi sulla base dell’omologia di sequenza e della selettività di substrato.[31] Sette di questi sono in grado di trasportare il fruttosio, e i più importanti a livello intestinale sono GLUT2 e GLUT5. Gli altri cinque trasportatori hanno gradi differenti di selettività per il monosaccaride e sono GLUT7, GLUT9a/b, GLUT8, GLUT11, e GLUT12.[5]
Di contro, glucosio e galattosio sono principalmente assorbiti a mezzo del trasportatore SGLT1, proteina transmembrana della famiglia dei co-trasportatori sodio-glucosio. SGLT1 opera un trasporto attivo dei due monosaccaridi sfruttando l’energia del gradiente elettrochimico transmembrana degli ioni sodio.[33]
GLUT5
L’assorbimento del fruttosio avviene nella parte distale del duodeno e nel digiuno, principalmente a mezzo del trasportatore GLUT5, un trasportatore insulino-indipendente.[5]
Tra i sette membri della famiglia GLUT in grado di trasportare il fruttosio, GLUT5 è il solo specifico per il monosaccaride, per il quale presenta una elevata affinità, con una Km di circa 6 mM, mentre non è in grado di trasportare ne glucosio ne galattosio.[10] E’ presente principalmente nell’intestino tenue, come GLUT2, ma si ritrova anche nel rene, nel tessuto adiposo, negli spermatozoi, nel testicolo, nel cervello e nel muscolo scheletrico.[15]
In fase prenatale sia i livelli dell’mRNA per GLUT5 nell’enterocita che la velocità di trasporto del fruttosio sono molto bassi, ma aumentano rapidamente con lo svezzamento, a prescindere dalla dieta. Dopo lo svezzamento i livelli dell’mRNA per GLUT5 possono essere ulteriormente indotti da diete contenti il monosaccaride.[8]
Sembra che un’alimentazione ricca in fruttosio induca a livello intestinale la sintesi di thioredoxin-interacting protein o TXNIP, proteina che si lega e regola GLUT5.[4]
Inoltre è stato anche dimostrato che ChREBP, un fattore di trascrizione che risponde all’assunzione di carboidrati, in particolare ai livelli di glucosio-6-fosfato, un metabolita chiave del metabolismo del glucosio, sia in grado di regolare la trascrizione di TXNIP e del gene che codifica per GLUT5 intestinale, ed è necessario per la tolleranza sistemica al fruttosio.[12]
A livello intestinale il fruttosio è assorbito ad una velocità inferiore a quella del glucosio.[15] Questo in parte potrebbe essere dovuto sia alla bassa attività di GLUT5 e GLUT2 nei suoi confronti che alle differenze esistenti nel meccanismo di assorbimento in quanto l’assorbimento del fruttosio avviene solo a mezzo di sistemi di trasporto passivi.
La velocità di assorbimento intestinale del fruttosio aumenta in caso di una sua assunzione cronica, in conseguenza della rapida up-regolazione del gene che codifica per GLUT5.
GLUT2
L’uscita dall’enterocita del fruttosio, che avviene a livello della membrana basolaterale, è mediata da GLUT2, il secondo maggior trasportatore intestinale del fruttosio, responsabile anche dell’uscita del glucosio e galattosio.[5]
E’ un trasportatore ad alta capacità e bassa affinità per il glucosio, fruttosio e galattosio, con Km rispettivamente di circa 17 mM, 67 Mm e 96 mM. Al pari di GLUT5 non è sensibile all’insulina.[15]
| Trasportatori | Valori approssimati della Km (mM) | ||
| D-Glucosio | D-Galattosio | D-Fruttosio | |
| SGLT1 | 0,5 | 1 | Nessuna interazione |
| GLUT2 | 17 | 96 | 67 |
| GLUT5 | Non determinato | Nessuna interazione | 6 |
Oltre che nell’intestino, GLUT2 si trova anche nelle cellule epiteliali del rene, negli epatociti, dove GLUT5 è scarsamente espresso, e nelle cellule beta del pancreas.[2] Poiché negli epatociti e nelle cellule epiteliali renali media l’assorbimento del fruttosio, è in grado di operare un trasporto facilitato bidirezionale.
Inoltre nelle cellule beta e negli epatociti agisce anche come sensore della concentrazione ematica del glucosio.[2]
Nota: GLUT8 può contribuire all’assorbimento epatico del fruttosio.[3]
Glucosio e assorbimento intestinale del fruttosio
La capacità di assorbire il fruttosio da parte dell’intestino è saturabile e, in un soggetto adulto sano, è compresa tra circa 5 g fino a oltre 50 g. Inoltre è influenzata dalla presenza nel lume intestinale del glucosio.[14]
Quando il fruttosio non è ingerito assieme al glucosio, non è assorbito molto efficientemente e, in condizioni fisiologiche, i sintomi del suo malassorbimento compaiono in modo dose-dipendente a partire da un carico di circa 12 g. Tuttavia, l’assunzione del solo fruttosio è piuttosto rara, essendo normalmente assunto, ad esempio, con il saccarosio o, ai pasti, con l’amido, un polisaccaride formato da unità di glucosio.
Sperimentalmente è stato osservato che la coingestione di glucosio con 50 g di fruttosio attenua i sintomi di malassorbimento in modo dose-dipendente, e, con miscele equimolari dei due monosaccaridi non è stato osservato alcun sintomo di malassorbimento fino a una quantità complessiva di zuccheri pari a 100 g.[22] Quindi l’assorbimento del fruttosio risulta massimo quando è presente, nel lume intestinale, in miscele equimolari con il glucosio. Degno di nota è che il meccanismo alla base di tale fenomeno non è ancora stato chiarito.
Queste osservazioni sono molto importanti ad esempio considerando l’alimentazione sportiva, in quanto, nel corso della competizione o dell’allenamento, l’atleta può necessitare di un elevato apporto di carboidrati nell’unità di tempo, che può essere ottenuto con miscele di maltodestrine, quindi glucosio, e fruttosio.[9]
Effetti intestinali del fruttosio non assorbito
Il fruttosio non assorbito provoca un aumento della pressione osmotica intraluminale nella parte distale del piccolo intestino e nel colon con conseguente richiamo di fluidi nel lume intestinale.[11]
Inoltre, al pari delle fibre, dell’amido resistente o degli zuccheri che sfuggano alla digestione e successivo assorbimento in quantità rilevanti, una volta raggiunto il colon può essere fermentato anaerobicamente dai batteri del microbiota intestinale, che è parte del più ampio microbiota umano.
Come risultato si ha una produzione eccessiva di gas, quali metano, anidride carbonica e idrogeno, e acidi grassi a catena corta, ossia acidi grassi la cui catena carboniosa ha un lunghezza compresa tra due e sei atomi, quali gli acidi acetico, propionico, butirrico e caproico, sebbene i principali prodotti nell’intestino siano i primi tre, in un rapporto molare pari a circa 60:20:20. Molti di questi metaboliti batterici possono influenzare la motilità intestinale e causare, assieme al richiamo di fluidi indotto dalla presenza di fruttosio non assorbito, vari sintomi gastrointestinali quali sensazioni di malessere, mal di stomaco, gonfiore e diarrea.[10]
Concentrazione ematica
Una volta lasciato l’enterocita, il fruttosio entra nella circolazione portale e da questa è veicolato principalmente al fegato. Il suo ingresso in circolo è più lento rispetto a quello del glucosio, i suoi livelli sono più bassi, ma vi permane più a lungo.[15]
Nei soggetti adulti sani la sua concentrazione sierica è pari a circa 0,008 mM, mentre quella plasmatica è pari a circa 0,03-0,04 mM.[5]
Se invece si considerano soggetti sani che consumino una dieta ad alto contenuto di fruttosio o saccarosio:
- nella circolazione periferica i livelli plasmatici possono aumentare acutamente anche di 10 volte, raggiungendo valori di 0,2-0,5 mM, quindi sempre nel range micromolare, per tornare ai livelli di digiuno entro due ore.
- nella circolazione portale la sua concentrazione plasmatica può invece raggiungere bassi valori millimolari, quindi maggiori dei precedenti.[10]
Pertanto esiste un forte gradiente di concentrazione del fruttosio tra i sangue che raggiunge il fegato e quello che lascia l’organo, il che significa che il fegato, e anche il pancreas, è esposto a concentrazioni di fruttosio maggiori rispetto ad altri organi non splancnici, come il cuore, il muscolo scheletrico e il cervello.[15]
Differenze nelle concentrazioni ematiche di fruttosio e glucosio
Nella circolazione portale, la concentrazione del fruttosio è molto più bassa rispetto a quelli del glucosio, pari a circa 5,5 mM. Queste differenze sono conseguenti alle differenze nella velocità di assorbimento intestinale e nella clearence epatica dei due monosaccaridi.[5]
A livello intestinale il fruttosio è assorbito a una velocità inferiore a quella del glucosio.[15] Questo in parte potrebbe essere dovuto, come già visto, sia alla bassa attività di GLUT5 e GLUT2 nei suoi confronti che al fatto che il suo assorbimento avviene a mezzo di sistemi di trasporto passivi.
La clearence epatica del fruttosio è molto più efficiente rispetto a quella del glucosio. Va infatti sottolineato che il fegato, che è il principale sito per il metabolismo del fruttosio, in grado di:
- estrarre dal sangue portale circa il 50-70% di un carico orale del monosaccaride, mentre estrae solamente un 15-30% di un carico orale di glucosio;
- riportare entro due ore la sua concentrazione plasmatica ai livelli di digiuno a seguito di un suo carico orale.
Anche i reni concorrono alla clearence del fruttosio, sebbene in misura minore rispetto al fegato, con circa un 20%.[5]
Fruttolisi epatica
Il fegato, e in misura minore l’intestino tenue e il rene, rappresentano i principali siti per il metabolismo del fruttosio o fruttolisi.[30] Ciò è conseguenza della presenza in queste sedi di tre enzimi necessari al metabolismo del monosaccaride, ossia la fruttochinasi (EC 2.7.1.4), la fruttosio-1-fosfato aldolasi o aldolasi B (EC 4.1.2.13), e la trioso chinasi (EC 2.7.1.28). I tre enzimi permettono la conversione del monosaccaride in intermedi della glicolisi e gluconeogenesi, ossia gliceraldeide-3-fosfato e diidrossiacetone fosfato.[19]
Una volta all’interno dell’epatocita il fruttosio viene fosforilato a fruttosio-1-fosfato nella reazione catalizzata dalla fruttochinasi. La reazione comporta il consumo di una molecola di ATP.
Fruttosio + ATP → Fruttosio-1-fosfato + ADP + H+
La fruttochinasi è caratterizzato da una bassa Km per il fruttosio, pari a circa 0,5 mM, ed è in grado di fosforilare rapidamente il monosaccaride. Di contro il fruttosio è uno scarso substrato per la glucochinasi (EC 2.7.1.2), per il quale ha un’affinità circa 20 volte inferiore rispetto a quella per il glucosio. Infine l’enzima, a differenza dell’esochinasi e della fosfofruttochinasi-1, non risponde alla carica energetica della cellula.[10]
A differenza della fruttochinasi dei mammiferi, la fruttochinasi vegetale fosforila il fruttosio nella posizione 6 a dare fruttosio-6-fosfato, al pari dell’enzima batterico.[26]
La fosforilazione intrappola il fruttosio all’interno della cellula, lo attiva per suo successivo metabolismo e ne mantiene bassa la concentrazione citosolica, il che favorisce il suo ulteriore ingresso nella cellula.[19]
Il fruttosio-1-fosfato prodotto viene scisso a dare diidrossiacetone fosfato e gliceraldeide, nella reazione catalizzata dalla fruttosio-1-fosfato aldolasi.
Fruttosio-1-fosfato → Diidrossiacetone Fosfato + Gliceraldeide
Mentre il diidrossiacetone fosfato è un intermedio della glicolisi e gluconeogenesi, la gliceraldeide deve essere fosforilata a gliceraldeide-3-fosfato per poter entrare nella via glicolitica o gluconeogenetica. La reazione è catalizzata dalla trioso chinasi e comporta il consumo di una molecola di ATP.[19]
Gliceraldeide + ATP → Gliceraldeide-3-fosfato + ADP + H+
La reazione complessiva è quindi:
Fruttosio + 2 ATP → 2 Gliceraldeide-3-fosfato +2 ADP +2 H+
Regolazione della fruttolisi epatica
Una volta prodotti i trioso fosfati, le vie metaboliche del glucosio e fruttosio convergono. Tuttavia, i passaggi che portano alla conversione di una molecola di fruttosio in due molecole di trioso fosfati non richiedono l’intervento ne della glucochinasi ne della fosfofruttochinasi-1. Ciò significa che queste molecole entrano nella via glicolitica a valle di due dei suoi principali punti di regolazione, e che pertanto la fruttolisi epatica non è soggetta a restrizioni legate alla carica energetica della cellula o all’azione di ormoni quali l’insulina o il glucagone.
Non essendo regolata, la fruttolisi è molto più veloce rispetto alla glicolisi, e, nel caso di un carico di fruttosio, può portare a una rapida espansione del pool dell’esoso monofosfato.[10]
Azioni regolatorie del fruttosio-1-fosfato
L’aumento della concentrazione intracellulare del fruttosio-1-fosfato influenza il metabolismo epatico del glucosio, in particolate la via glicolitica, essendo in grado di modulare l’attività di due suoi enzimi: la glucochinasi e la piruvato chinasi (EC 2.7.1.40).[10]
La glucochinasi viene attivata grazie al fatto che il fruttosio-1-fosfato ne promuove il rilascio da GRP, una proteina inibitoria che lega la forma inattiva dell’enzima nel nucleo. Ciò promuove la fosforilazione e l’uptake del glucosio, e la sintesi del glicogeno.[16]
Il fruttosio-1-fosfato è un attivatore allosterico della piruvato chinasi, l’enzima che catalizza l’ultima tappa della glicolisi, contribuendo così all’aumento dei livelli circolanti di lattato conseguenti all’ingestione di fruttosio.[7]
Inoltre il fruttosio-1-fosfato può:
- incrementare la sintesi del glicogeno epatico inibendo allostericamente la glicogeno fosforilasi (EC EC 2.4.1.1), enzima della glicogenolisi;[32]
- stimolare la sintesi di acido urico attivando allostericamente la AMP deaminasi (EC 3.5.4.6).[10]
Destino dei trioso fosfati
I trioso fosfati derivanti dalla fruttolisi possono entrare nella gluconeogenesi, nella lipogenesi o nelle vie ossidative.[29]
Nel fegato, il principale destino metabolico del fruttosio è quello di essere convertito in glucosio attraverso la gluconeogenesi, per essere rilasciato in circolo o accumulato in forma di glicogeno, in base alle necessità di regolazione della glicemia.
- Se si considera un soggetto a digiuno, i bassi livelli di fruttosio-2,6-bisfosfato inibiscono la fosfofruttochinasi-1 (EC 2.7.1.11), e quindi la glicolisi, mentre permettono l’attivazione della fruttosio-1,6-bisfosfatasi, e quindi della gluconeogenesi. In queste condizioni l’assunzione di fruttosio porterà i trioso fosfati derivati dal fruttosio di preferenza verso sintesi di glucosio e il suo rilascio in circolo al fine di mantenere a livelli normali la glicemia.[10] Un discorso simile vale nel corso dell’esercizio fisico.
- Al contrario, nello stato alimentato i trioso fosfati derivanti dalla fruttolisi saranno utilizzati come substrato per la sintesi del glicogeno.[15]
Parte del fruttosio può essere anche essere ossidato ad anidride carbonica e acqua per la produzione di ATP attraverso il ciclo di Krebs, o a lattato che è quindi rilasciato in circolo, in una sorta di ciclo di Cori inverso, il che può essere vantaggioso per il muscolo che lavora in quanto rappresenta un ulteriore substrato energetico. L’ossidazione a lattato e il suo successivo rilascio in circolo può essere vantaggioso per il muscolo che lavora in quanto lo rifornisce di un ulteriore substrato da cui ricavare energia.[28]
Una piccola frazione dei trioso fosfati derivanti dal fruttosio può essere utilizzata per la sintesi degli acidi grassi e quindi dei trigliceridi.[27]
Infine, è stato osservato che in soggetti adulti sani un’ingestione acuta di fruttosio si associa a una riduzione dei livelli degli acidi grassi liberi circolanti. Ciò può essere dovuto a un’aumentata clearence degli stessi acidi grassi o a una inibizione della lipolisi nel tessuto adiposo. Tuttavia il meccanismo alla base di questo effetto non è ancora stato chiarito.[29]
Fruttosio e gotta
La gotta è una condizione infiammatoria delle articolazioni dovuta alla deposizione nelle stesse di cristalli di acido urico, deposizione conseguente alla presenza di elevati livelli circolanti di acido urico.
La gotta è stata associata anche a elevate assunzioni di fruttosio.[28] Perché?
La rapida fosforilazione epatica del fruttosio può causare una riduzione dei livelli intracellulare di fosfato libero, che, a sua volta, può aumentare la produzione di acido urico attraverso l’attivazione della AMP deaminasi, che è anche attivata dal fruttosio-1-fosfato. La rapida fosforilazione del fruttosio provoca una riduzione della concentrazione di ATP e aumento della concentrazione dell’AMP. L’AMP deaminasi, catalizzando la conversione dell’AMP in IMP, avvia il nucleotide verso la conversione in acido urico.[32]
Infine, il fruttosio può contribuire alla produzione di acido urico anche stimolando la sintesi delle purine.[21]
Sintesi endogena
Sebbene la maggior parte del fruttosio derivi dall’alimentazione, gli animali, e quindi anche l’uomo, sono in grado di produrlo attraverso la via dei polioli.[30] Presente in numerosi tessuti e organi, permette la conversione del glucosio in fruttosio, via sorbitolo.[20]
- Nel primo passaggio il glucosio è ridotto a sorbitolo in una reazione catalizzata dalla aldoso reduttasi (EC 1.1.1.21), una reduttasi NADPH dipendente dotata di un’ampia specificità per i monosaccaridi essendo in grado di ridurre anche il galattosio a galattitolo.
- Nel passaggio successivo il sorbitolo è ossidato a fruttosio in una reazione catalizzata dalla sorbitolo deidrogenasi (EC 1.1.1.14), reduttasi NADH dipendente.
E’ ovviamente possibile anche la sintesi del monosaccaride direttamente dal sorbitolo, che è ampiamente distribuito nella frutta e verdura.
Il fruttosio sintetizzato per via endogena rappresenta la fonte primaria di energia per gli spermatozoi e potrebbe essere importante per la fertilità.[10]
Errori congeniti del metabolismo del fruttosio
Il metabolismo del fruttosio è interessato da due errori congeniti, la fruttosuria essenziale o benigna e l’intolleranza ereditaria al fruttosio, entrambe malattie autosomiche recessive.
- La fruttosuria essenziale o benigna è dovuta alla deficienza della fruttochinasi epatica. Descritta per la prima volta nel 1876, è una condizione asintomatica e benigna, e in molti casi non viene neppure rilevata.[30] A seguito dell’ingestione di fruttosio, saccarosio o sorbitolo si osserva elevati livelli plasmatici di fruttosio, che è parzialmente escreto come tale con le urine mentre la parte non escreta può essere fosforilata dalla esochinasi nel tessuto adiposo e muscolare, a dare fruttosio-6-fosfato.
Data la sua natura benigna non è raccomandata alcun restrizione alimentare. - L’intolleranza ereditaria al fruttosio solitamente si manifesta al momento dello svezzamento, quando nella dieta vengono introdotti alimenti che contengono il monosaccaride.[13]
E’ dovuta alla deficienza della fruttosio-1-fosfato aldolasi. Data l’elevata attività della fruttochinasi, si verifica un accumulo citosolico di fruttosio-1-fosfato e l’intrappolamento del fosfato. Ciò porta a una caduta della glicemia postprandiale causata dall’inibizione della gluconeogenesi e della glicogenolisi. Inoltre, il sovrautilizzo dell’ATP, che è il donatore del fosfato nella reazione catalizzata dalla fruttochinasi, e la sua ridotta rigenerazione portano alla sua deplezione, cui segue un aumento del rilascio di ioni magnesio e della produzione di acido urico.[30]
L’intolleranza ereditaria al fruttosio causa disfunzioni renali ed epatiche e può essere fatale. Tuttavia i soggetti affetti sviluppano i sintomi solo quando sono esposti al monosaccaride, per cui la terapia consiste in una dieta priva di fruttosio.
Bibliografia
- ^ American Chemical Society. Fructose. 2017 https://www.acs.org/molecule-of-the-week/archive/f/fructose.html
- ^ a b Cura A.J., Carruthers A. Role of monosaccharide transport proteins in carbohydrate assimilation, distribution, metabolism, and homeostasis. Compr Physiol 2012;2(2):863-914. doi:10.1002/cphy.c110024
- ^ DeBosch B.J., Chen Z., Saben J.L., Finck B.N., Moley K.H. Glucose transporter 8 (GLUT8) mediates fructose-induced de novo lipogenesis and macrosteatosis. J Biol Chem 2014;289(16):10989-10998. doi:10.1074/jbc.M113.527002
- ^ Dotimas J.R., Lee A.W., Schmider A.B., Carroll S.H., Shah A., Bilen J., Elliott K.R., Myers R.B., Soberman R.J., Yoshioka J., Lee R.T. Diabetes regulates fructose absorption through thioredoxin-interacting protein. Elife. 2016;5:e18313. doi:10.7554/eLife.18313
- ^ a b c d e f g h Douard V., Ferraris R.P. Regulation of the fructose transporter GLUT5 in health and disease. Am J Physiol Endocrinol Metab 2008;295(2):E227-37. doi:10.1152/ajpendo.90245.2008
- ^ Dubrunfaut A. P. Sur une propriété analytique des fermentations alcoolique et lactique, et sur leur application à l’étude des sucres. Annales de Chimie et de Physique 1847;21:169-178
- ^ Eggleston L.V., Woods H.F. Activation of liver pyruvate kinase by fructose-1-phosphate. FEBS Lett 197015;6(1):43-45. doi:10.1016/0014-5793(70)80038-2
- ^ Ferraris R.P. Dietary and developmental regulation of intestinal sugar transport. Biochem J. 2001;360(Pt 2):265-76. doi:10.1042/0264-6021:3600265
- ^ Fuchs C.J., Gonzalez J.T., van Loon L.J.C. Fructose co-ingestion to increase carbohydrate availability in athletes. J Physiol 2019;597(14):3549-3560. doi:10.1113/JP277116
- ^ a b c d e f g h i Hannou S.A., Haslam D.E., McKeown N.M., Herman M.A. Fructose metabolism and metabolic disease. J Clin Invest 2018;128(2):545-555. doi:10.1172/JCI96702
- ^ Holtug K., Clausen M.R., Hove H., Christiansen J., Mortensen P.B. The colon in carbohydrate malabsorption: short-chain fatty acids, pH, and osmotic diarrhoea. Scand J Gastroenterol 1992;27(7):545-52. doi:10.3109/00365529209000118
- ^ Kim M., Astapova I.I., Flier S.N., Hannou S.A., Doridot L., Sargsyan A., Kou H.H., Fowler A.J., Liang G., Herman M.A. Intestinal, but not hepatic, ChREBP is required for fructose tolerance. JCI Insight 2017;2(24):e96703. doi:10.1172/jci.insight.96703
- ^ a b Kim M., Moon J.S., Kim M.J., Seong M.W., Park S.S., Ko J.S. Hereditary fructose intolerance diagnosed in adulthood. Gut Liver. 2021;15(1):142-145. doi:10.5009/gnl20189
- ^ Latulippe M.E., Skoog S.M. Fructose malabsorption and intolerance: effects of fructose with and without simultaneous glucose ingestion. Crit Rev Food Sci Nutr 2011;51(7):583-92. doi:10.1080/10408398.2011.566646
- ^ a b c d e f g Laughlin M.R. Normal roles for dietary fructose in carbohydrate metabolism. Nutrients 2014;6(8):3117-3129. doi:10.3390/nu6083117
- ^ McGuinness O..P., Cherrington A.D. Effects of fructose on hepatic glucose metabolism. Curr Opin Clin Nutr Metab Care 2003;6(4):441-8. doi:10.1097/01.mco.0000078990.96795.cd
- ^ Miller W.A. Elements of chemistry: theoretical and practical. Part III. John W. Parker and Son. 1857
- ^ National Center for Biotechnology Information. PubChem Compound Summary for CID 2723872, D-Fructose. https://pubchem.ncbi.nlm.nih.gov/compound/fructose. Accessed Dec. 18, 2023
- ^ a b c d Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 6th Edition. W.H. Freeman and Company, 2012
- ^ a b Oates P.J. Polyol pathway and diabetic peripheral neuropathy. Int Rev Neurobiol 2002;50:325-92. doi:10.1016/s0074-7742(02)50082-9
- ^ Raivio K.O., Becker M.A., Meyer L.J., Greene M.L., Nuki G., Seegmiller J.E. Stimulation of human purine synthesis de novo by fructose infusion. Metabolism 1975;24(7):861-9. doi:10.1016/0026-0495(75)90133-x
- ^ Riby J.E., Fujisawa T., Kretchmer N. Fructose absorption. Am J Clin Nutr 1993;58(5 Suppl):748S-753S. doi:10.1093/ajcn/58.5.748S
- ^ Rosenthal M.D., Glew R.H. Medical biochemistry: human metabolism in health and disease. A John Wiley & sons, Inc., Publication, 2009
- ^ a b Shallenberger R.S. Intrinsic chemistry of fructose. Pure Appl Chem 1978;50(11-12):1409-1420. doi:10.1351/pac197850111409
- ^ Soderberg T. Organic chemistry with a biological emphasis. Volume II. Chemistry Publications. 2019
- ^ Stein O., Granot D. Plant fructokinases: evolutionary, developmental, and metabolic aspects in sink tissues. Front Plant Sci 2018;9:339. doi:10.3389/fpls.2018.00339
- ^ Tappy L., Lê K.A. Metabolic effects of fructose and the worldwide increase in obesity. Physiol Rev 2010;90(1):23-46. doi:1152/physrev.00019.2009
- ^ a b c Tappy L., Rosset R. Fructose metabolism from a functional perspective: implications for athletes. Sports Med 2017;47(Suppl 1):23-32. doi:1007/s40279-017-0692-4
- ^ a b Ter Horst K.W., Serlie M.J. Fructose consumption, lipogenesis, and non-alcoholic fatty liver disease. Nutrients 2017;9(9):981. doi:10.3390/nu9090981
- ^ a b c d e f Tran C. Inborn errors of fructose metabolism. What can we learn from them? Nutrients 20173;9(4):356. doi:10.3390/nu9040356
- ^ Uldry M., Thorens B. The SLC2 family of facilitated hexose and polyol transporters. Pflugers Arch 2004;447(5):480-9. doi:10.1007/s00424-003-1085-0
- ^ a b Van Den Berghe G., Hue L., Hers H.G. Effect of administration of the fructose on the glycogenolytic action of glucagon. An investigation of the pathogeny of hereditary fructose intolerance. Biochem J 1973;134(2):637-45. doi:10.1042/bj1340637
- ^ Wright E.M., Hirayama B.A., Loo D.F. Active sugar transport in health and disease. J Intern Med 2007;261(1):32-43. doi:10.1111/j.1365-2796.2006.01746.x
- ^ a b c Ziesenitz S.C. Authorised EU health claim for fructose in foods, nutrients and food ingredients with authorised EU health claims: Volume 2, 2015 doi:10.1016/B978-1-78242-382-9.00011-6