Il galattosio è un monosaccaride a sei atomi di carbonio.
Isolato per la prima volta da Louis Pasteur dal latte nel 1855, la sua struttura fu chiarita trent’anni più tardi da Morrell R. e Fischer E.[15] Nel 1860 Berthelot P.E.M. lo chiamò glucosio lattico o galattosio, dal greco galaktos, che significa latte, più il suffisso per gli zuccheri –ose.[2]
Può esistere in forma a catena aperta e in forma ciclica. La forma a catena aperta presenta un gruppo carbonilico a una estremità della catena, il che ne fa un derivato aldeidico, e quindi un aldoesoso e uno zucchero riducente. In forma ciclica presenta quattro stereoisomeri.[14]
La principale fonte è il disaccaride lattosio, che è formato da una molecola di galattosio e una di glucosio unite da un legame glicosidico β-(1→4). Nell’intestino tenue il legame glicosidico del disaccaride è scisso nella reazione catalizzata dalla lattasi (EC 3.2.1.108) a dare glucosio e galattosio, che sono quindi assorbiti.[18]
Il galattosio esercita un’ampia gamma di funzioni. Previa conversione in UDP-galattosio e UDP-glucosio attraverso la via di Leloir può essere utilizzato sia a scopi anabolici che catabolici, a seconda del tipo di tessuto e dello stato energetico della cellula.[5][11]
Un difetto a carico in uno degli enzimi della via di Leloir porta a un accumulo anomalo in molti organi e tessuti di galattitolo e galattonato, molecole derivanti dal galattosio, e causa la galattosemia.[22]
Indice
- Proprietà chimiche
- Fonti alimentari
- Assorbimento intestinale
- Metabolismo del galattosio
- Galattosemia
- Bibliografia
Proprietà chimiche
Come tutti gli altri esosi, quali il glucosio e il fruttosio, ha formula molecolare C6H12O6 e massa molare di 180,156 g/mol.
Ha una dolcezza pari al 33% di quella del saccarosio, ed è dolce circa la metà rispetto al glucosio.[13]
Al pari degli altri aldoesosi, ha due enantiomeri che, in base alla convenzione di Fischer o sistema D-L sono detti D-galattosio e L-galattosio. Quest’ultimo non è presente naturalmente negli organismi superiori in quanto non può essere metabolizzato. Pertanto, con il termine di galattosio ci si riferirà all’enantiomero D.
Può esistere in forma ciclica e a catena aperta. La forma a catena aperta, che può essere rappresentata ricorrendo alle proiezioni di Fischer, ha un gruppo aldeidico, e quindi un gruppo carbonilico, a una estremità della molecola.
Il gruppo carbonilico fa si che il galattosio, al pari degli altri monosaccaridi, e del lattosio e maltosio tra i disaccaridi, sia uno zucchero riducente.[14]
Struttura
La forma a catena aperta è termodinamicamente instabile e in soluzione è presente in tracce.
Poiché aldeidi e chetoni possono reagire con l’alcol, la forma a catena aperta del galattosio può ciclizzare a seguito dell’attacco nucleofilo dell’atomo di ossigeno di uno dei gruppi ossidrilici al carbonio carbonilico a formare un emiacetale ciclico.[19]
I composti ciclici con anelli a tre o quattro atomi sono molto meno stabili di quelli a cinque e, soprattutto, a sei atomi, a causa delle elevate interazioni steriche presenti, in analogia a quanto accade con gli alcani ciclici, come il ciclopropano e ciclobutano, meno stabili del ciclopentano e cicloesano.
Nella forma ciclica, il galattosio presenta quattro stereoisomeri, due con un anello a cinque atomi, quattro atomi di carbonio e uno di ossigeno, ossia un anello furanosico, e due con un anello a sei atomi, cinque di carbonio e uno di ossigeno, quindi un anello piranosico.[20]
In soluzione, le forme piranosiche e furanosiche sono in equilibrio con la forma a catena aperta ma, poiché la forma furanosica è meno stabile della piranosica, l’equilibrio è fortemente spostato verso quest’ultima.[14]
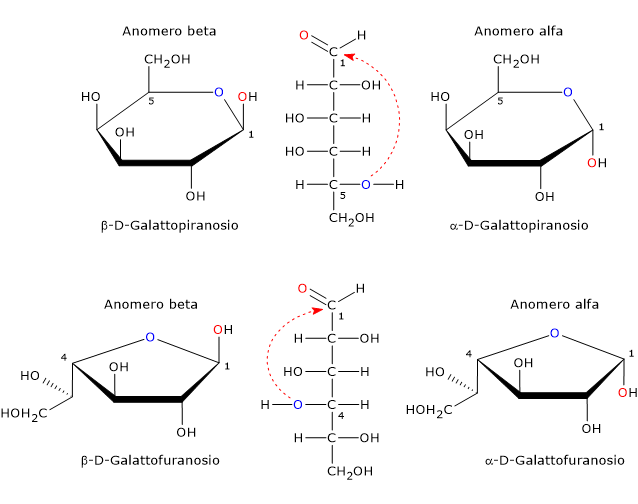
Nei mammiferi è presente la sola forma piranosica, che è un epimero del glucosio differendone solamente per la configurazione del gruppo ossidrilico sul C4. La forma furanosica si trova in molti organismi inferiori, sia procarioti che eucarioti, come batteri, alghe verdi, funghi, protozoi, come Tripanosomatidi, spugne e stelle marine. La forma furanosica si trova anche in specie patogene dove può svolgere un ruolo importante, ad esempio per la sopravvivenza, mentre la sua via biosintetica può essere un bersaglio per lo sviluppo di nuovi farmaci per il trattamento delle infezioni causate dai patogeni stessi.[20]
Anomeri
Il carbonio emiacetalico, un carbonio tetraedrico che lega quattro ligandi differenti, è un centro di chiralità.
Poiché l’attacco nucleofilo dell’atomo di ossigeno può avvenire sia dalla parte superiore che inferiore rispetto al piano sp2 del carbonio carbonilico, la reazione di chiusura dell’anello potrà dar luogo alla formazione di due configurazioni piranosiche e due furanosiche che differiranno solamente nella configurazione del carbonio emiacetalico. Questo fenomeno è detto mutarotazione e da luogo alla formazione di due coppie di epimeri.
Tali epimeri differiscono nella configurazione del carbonio emiacetalico e sono detti anomero alfa e anomero beta, mentre il carbonio emiacetalico diventa il carbonio anomerico o centro anomerico.
Si avrà l’anomero alfa quando l’attacco nucleofilo avviene da sopra rispetto al piano sp2, e in questo caso il gruppo ossidrilico legato al C1 si trova al di sotto del piano equatoriale, e viceversa l’anomero beta, nel quale il gruppo ossidrilico si trova al di sopra del piano equatoriale della molecola.
Dunque, se si considerano i possibili anomeri e la forma a catena aperta, il galattosio può esistere in cinque forme differenti: alfa-D-galattopiranosio e beta-D-galattopiranosio, alfa-D-galattofuranosio e beta-D-galattofuranosio, e la forma a catena aperta.[19]
Nota: l’anomeria è un tipo di isomeria ottica caratteristica dei monosaccaridi.
Fonti alimentari
La maggior parte del galattosio presente nella dieta deriva dal latte e latticini, dove si trova principalmente nella molecola del lattosio, e, in misura minore, come componente di carboidrati più complessi, quali oligosaccaridi e polisaccaridi, detti glicani, componenti a loro volta dei glicolipidi e glicoproteine del latte.[7]
E’ presente anche in molti altri alimenti, quali frutta, verdura, cereali, legumi, noci e miele, dove si ritrova in forma libera, legato a polifenoli quali flavonoli e antociani, o come componente di glicoproteine e glicolipidi.[6] Nella forma legata è spesso impegnato in legami resistenti all’attacco delle idrolasi intestinali.[1]
In forma libera è presente in quantità dell’ordine dei milligrammi. Di seguito alcuni esempi:
- inferiori a 0,1 mg/100 g di parte edibile: carciofi, funghi, olive, e arachidi;
- oltre 10 mg/100 g di parte edibile: peperoni, datteri, papaia, anguria, pomodoro;
- fino a 35,4 mg/100 g di parte edibile: cachi.
Sebbene siano valori molto bassi devono essere presi in considerazione in caso di galattosemia.[8]
Assorbimento intestinale
Nei mammiferi la digestione dei carboidrati inizia nella bocca e termina nel duodeno e digiuno, dove idrolasi quali la alfa-amilasi pancreatica e le disaccaridasi presenti nella membrana dell’orletto a spazzola degli enterociti idrolizzano disaccaridi, oligosaccaridi e polisaccaridi nei monosaccaridi costituenti, quindi glucosio, fruttosio e galattosio.[18]
L’idrolisi del lattosio a dare glucosio e beta galattosio è catalizzata dalla disaccaridasi lattasi o lattasi florizin-idrolasi, enzima che presenta due siti attivi. Un sito attivo idrolizza il legame glicosidico β-(1→4), dunque una beta-glucosidasi, mentre l’altro ha attività florizin idrolasica, essendo in grado di idrolizzare la florizina e i glicolipidi, come le ceramidi a dare sfingosina e acidi grassi.[24]
Anche la beta-galattosidasi batterica (EC 3.2.1.23) dello yogurt è in grado di idrolizzare il lattosio nei monosaccaridi costituenti.[17]
L’assorbimento dei monosaccaridi glucosio e galattosio avviene nell’intestino tenue ed è mediato dal trasportatore SLGT1, una proteina integrale di membrana che opera un trasporto attivo sfruttando l’energia del gradiente elettrochimico transmembrana del sodio.[23]
Il galattosio lascia l’enterocita a livello della membrana basolaterale per diffusione facilitata mediata dal trasportatore GLUT2. Una volta in circolo viene veicolato dal sistema portale al fegato, il principale sito per il suo metabolismo, assorbendone quasi il 90%. L’ingresso negli epatociti è mediato da GLUT2.[23] Il galattosio non assorbito dal fegato potrà raggiungere altri organi, come la ghiandola mammaria in fase di allattamento.
In condizioni fisiologiche si può osservare un aumento della concentrazione ematica del galattosio a seguito dell’assunzione di alcol, che ne riduce l’assorbimento intestinale e il successivo metabolismo epatico.
Metabolismo del galattosio
In assenza di lattosio o altre fonti alimentari di galattosio, il monosaccaride può essere sintetizzato a partire dal glucosio, in quanto la reazione catalizzata dalla UDP-galattosio 4-epimerasi (EC 5.1.3.2), uno dei quattro enzimi della via di Leloir, può procedere in entrambe le direzioni.[18]
In aggiunta alla sintesi de novo e all’apporto con la dieta è molto importante il galattosio derivante dal turnover delle glicoproteine e glicolipidi.[4]
Il galattosio può entrare in tre vie metaboliche principali, la più importante delle quali è la via di Leloir, grazie alla quale può essere convertito in glucosio. Le altre due vie, una ossidativa che porta alla formazione del galattonato e una riduttiva che porta alla conversione del galattosio in galattitolo, in condizioni fisiologiche hanno un ruolo marginale, mentre divengono importanti quando i livelli intracellulari di galattosio sono molto elevati, come nella galattosemia.[5]
Via di Leloir
La via di Leloir, scoperta nel 1948 da Leloir L.F. e colleghi, attraverso quattro reazioni enzimatiche porta all’inversione della configurazione del gruppo ossidrilico legato al C4 del galattosio a dare glucosio.[11]
- Il beta galattosio, un prodotto della digestione del lattosio, viene convertito nell’anomero alfa nella reazione catalizzata dalla galattosio mutarotasi (EC 5.1.3.3).[21]
- Nel passaggio successivo la galattochinasi (EC 2.7.1.6) catalizza la fosforilazione del galattosio a galattosio-1-fosfato.[9] La fosforilazione blocca all’interno della cellula il monosaccaride e ne mantiene bassa la concentrazione intracellulare, favorendone il trasporto all’interno della cellula.
- Il galattosio-1-fosfato viene attivato a UDP-galattosio nella reazione catalizzata dalla galattosio-1-fosfato uridiltransferasi (EC 2.7.7.12).
- Infine si verifica l’epimerizzazione dell’UDP-galattosio a UDP-glucosio nella reazione catalizzata dalla UDP-galattosio 4-epimerasi.[9]
La via di Leloir permette l’attivazione del galattosio a UDP-galattosio che può essere utilizzato nelle reazioni di glicosilazione di lipidi e proteine.[5] Questo consente al galattosio di svolgere un ruolo strutturale chiave nelle prime fasi dello sviluppo, e di essere un componente degli antigeni presenti su globuli rossi, in particolare degli antigeni del gruppo AB0.
Nella ghiandola mammaria in allattamento l’UDP-galattosio è un precursore per la sintesi del lattosio, costituendo circa il 30% del galattosio presente nel disaccaride, e viene utilizzato anche nelle reazioni di glicosilazione delle proteine e lipidi del latte stesso.[18]
L’UDP-glucosio, a seconda del tipo di tessuto e della carica energetica della cellula, può:
- essere utilizzato nelle reazioni di glicosilazione;
- nella sintesi del glicogeno, il principale destino metabolico del galattosio nel fegato;
- può entrare nella glicolisi per essere utilizzato a fini energetici
- può entrare nella gluconeogenesi, previa conversione in glucosio-1-fosfato nella reazione catalizzata dalla UDP-glucosio pirofosforilasi (EC 2.7.7.9), e successiva isomerizzazione a glucosio-6-fosfato nella reazione catalizzata dalla fosfoglucomutasi (EC 5.4.2.2).[4][5]
Poichè la UDP-glucosio pirofosforilasi catalizza una reazione reversibile, la sintesi dell’UDP-galattosio dal galattosio-1-fosfato e UTP potrebbe rappresentare una via metabolica alternativa nei soggetti con deficienza di galattosio-1-fosfato uridiltransferasi.[12]
Galattitolo
Una via metabolica alternativa alla via di Leloir porta alla riduzione del galattosio a galattitolo nella reazione catalizzata dalla aldoso reduttasi (EC 1.1.1.21), una reduttasi NADPH dipendente dotata di un’ampia specificità per i monosaccaridi, essendo in grado di ridurre anche il glucosio a sorbitolo.[4]
L’enzima ha una bassa affinità per il galattosio per cui in condizioni fisiologiche il galattitolo è presente in tracce, mentre, nel caso in cui il galattosio si accumuli in quantità elevate, come nella galattosemia, la sua produzione aumenta.
Mentre il sorbitolo può essere convertito a fruttosio nella reazione catalizzata dalla sorbitolo deidrogenasi (EC 1.1.99.21), il galattitolo non è ulteriormente metabolizzato e si accumula nella cellula in quanto scarsamente liposolubile, quindi non in grado di attraversare la membrana plasmatica.[5]
Nota: la via metabolica che porta alla conversione del glucosio in fruttosio è chiamata via dei polioli.
Galattonato
La seconda via metabolica alternativa alla via di Leloir porta all’ossidazione del galattosio a galattonato.[4]
- Nel primo passaggio il galattosio è ossidato a galattono-1,4-lattone, nella reazione catalizzata dalla galattosio deidrogenasi (EC 1.1.1.48); nella reazione il NAD+ funge da agente ossidante e si riduce.
- Nel secondo passaggio il legame lattonico viene idrolizzato, in una reazione che può procedere spontaneamente o essere catalizzata da una lattonasi (EC 3.1.1.25), a dare il galattonato che può essere escreto con le urine o ulteriormente ossidato a β-cheto-galattonato nella reazione catalizzata dalla β-L-idrossiacido deidrogenasi, reazione che porta alla produzione di NADH.
- Nell’ultimo passaggio il β-cheto-galattonato viene decarbossilato a xilulosio, in una reazione enzimatica di cui non è ancora stata individuata la decarbossilasi, con liberazione del C1 in forma di CO2.
Infine lo xilulosio può entrare nella via del pentoso fosfato a seguito della sua fosforilazione a xilulosio-5-fosfato nella reazione catalizzata dalla ATP:D-xilulosio-5-fosfotransferasi o xilulochinasi (EC 2.7.1.17).[10]
Galattosemia
La galattosemia è una malattia metabolica genetica causata da un difetto a carico di uno dei geni che codificano per gli enzimi della via di Leloir.
Descritta per la prima volta da von Reuss A. nel 1908, è caratterizzata da un anomalo accumulo di galattonato e galattitolo in molti organi del corpo.[22]
Tra i sintomi si ritrova la cataratta, che spesso compare precocemente, entro i primi due anni di vita, mentre nei casi più severi si hanno anche danni ai reni, fegato e cervello.
Riguardo alla cataratta sembra tra i fattori scatenanti ci siano anche la sintesi e l’accumulo di galattitolo nella lente in quanto:
- essendo osmoticamente attivo, determina un aumento della pressione osmotica con conseguente richiamo d’acqua nella cellula e possibile rottura della membrana plasmatica;[4]
- la sua sintesi causa una deplezione di NADPH che, riducendo l’attività della glutatione reduttasi (EC 1.8.1.7), determina un incremento dei radicali liberi e quindi dello stress ossidativo.[16]
Attualmente, lo standard terapeutico per la cura della galattosemia è una dieta a ridotto contenuto di galattosio.[3]
Bibliografia
- ^ Acosta P.B., Gross K.C. Hidden sources of galactose in the environment. Eur J Pediatr 1995;154(7 Suppl 2):S87-92. doi:10.1007/BF02143811
- ^ Berthelot M. Chimie organique fondée sur la synthèese Vol. 1, 1860. Mallet-Bachelier
- ^ Coelho A.I., Berry G.T., Rubio-Gozalbo M.E. Galactose metabolism and health. Curr Opin Clin Nutr Metab Care 2015;18(4):422-427. doi:10.1097/MCO.0000000000000189
- ^ a b c d e Coelho A.I., Rubio-Gozalbo M.E., Vicente J.B., Rivera I. Sweet and sour: an update on classic galactosemia. J Inherit Metab Dis 2017;40(3):325-342. doi:10.1007/s10545-017-0029-3
- ^ a b c d e Conte F., van Buuringen N., Voermans N.C., Lefeber D.J. Galactose in human metabolism, glycosylation and congenital metabolic diseases: time for a closer look. Biochim Biophys Acta Gen Subj 2021;1865(8):129898. doi:10.1016/j.bbagen.2021.129898
- ^ de la Rosa L.A., Alvarez-Parrilla E., Gonzàlez-Aguilar G.A. Fruit and vegetable phytochemicals: chemistry, nutritional value, and stability. 1th Edition. Wiley J. & Sons, Inc., Publication, 2010
- ^ Flynn A. Galactosemia. Editor(s): McSweeney P.L.H., McNamara J.P. Encyclopedia of dairy sciences. 3th Edition. Academic Press, 2022;853-858. doi:10.1016/B978-0-12-818766-1.00094-5
- ^ Gross K. C., Acosta P. B. Fruits and vegetables are a source of galactose: implications in planning the diets of patients with galactosaemia. J Inherit Metab Dis 1991;14(2):253-258. doi:10.1007/BF01800599
- ^ a b Holden H.M., Rayment I., Thoden J.B. Structure and function of enzymes of the Leloir pathway for galactose metabolism. J Biol Chem 2003;278(45):43885-43888. doi:10.1074/jbc.r300025200
- ^ Lai K., Klapa M.I. Alternative pathways of galactose assimilation: could inverse metabolic engineering provide an alternative to galactosemic patients? Metab Eng. 2004 Jul;6(3):239-44. doi:10.1016/j.ymben.2004.01.001
- ^ a b Leloir L.F., de Fekete M.A., Cardini C.E. Starch and oligosaccharide synthesis from uridine diphosphate glucose. J Biol Chem 1961;236:636-41. doi:10.1016/S0021-9258(18)64280-2
- ^ Leslie N., Yager C., Reynolds R., Segal S. UDP-galactose pyrophosphorylase in mice with galactose-1-phosphate uridyltransferase deficiency. Mol Genet Metab 2005;85(1):21-7. doi:10.1016/j.ymgme.2005.01.004
- ^ National Center for Biotechnology Information. PubChem Compound Summary for CID 6036, D-Galactose. https://pubchem.ncbi.nlm.nih.gov/compound/D-Galactose. Accessed Dec. 10, 2023
- ^ a b c Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 6th Edition. W.H. Freeman and Company, 2012
- ^ Pasteur L. Note sur le sucre de lait. 1856
- ^ Pintor J. Sugars, the crystalline lens and the development of cataracts. Biochem Pharmacol 2012;1:4. doi: 10.4172/2167-0501.1000e119
- ^ Richmond M.L., Gray J.I., and Stine C.M. Beta-galactosidase: review of recent research related to technological application, nutritional concerns, and immobilization. J Dairy Sci 1981;64:1759-1771. doi: 10.3168/jds.S0022-0302(81)82764-6
- ^ a b c d Rosenthal M.D., Glew R.H. Medical biochemistry: human metabolism in health and disease. A John Wiley & sons, Inc., Publication, 2009
- ^ a b Soderberg T. Organic chemistry with a biological emphasis. Volume II. Chemistry Publications. 2019 https://digitalcommons.morris.umn.edu/chem_facpubs/2
- ^ a b Tefsen B., Ram A.F.J., van Die I., Routier F.H. Galactofuranose in eukaryotes: aspects of biosynthesis and functional impact. Glycobiology 2012;22(4):456-469. doi:10.1093/glycob/cwr144
- ^ Thoden J.B., Timson D.J., Reece R.J., and M. Holden H.M. Molecular structure of human galactose mutarotase. J Biol Chem 2004;279(22):23431-23437. doi:10.1074/jbc.M402347200
- ^ a b Timson D.J. Type IV galactosemia. Genet Med 2019;21:1283-1285. doi:10.1038/s41436-018-0359-z
- ^ a b Wright E.M., Hirayama B.A., Loo D.F. Active sugar transport in health and disease. J Intern Med 2007;261(1):32-43. doi: 10.1111/j.1365-2796.2006.01746.x. PMID: 17222166
- ^ Zecca L., Mesonero J.E., Stutz A., Poirée J.C., Giudicelli J., Cursio R., Gloor S.M., Semenza G. Intestinal lactase-phlorizin hydrolase (LPH): the two catalytic sites; the role of the pancreas in pro-LPH maturation. FEBS Lett 1998;435(2-3):225-8. doi: 10.1016/s0014-5793(98)01076-x