Il metabolismo del glicogeno si compone di due fasi: una fase costruttiva in cui si verifica la sintesi del glicogeno, ed una fase degradativa, detta glicogenolisi, in cui il polisaccaride viene catabolizzato.
La glicogenolisi libera glucosio quando questo è necessario.
Nel fegato, il glicogeno rappresenta una riserva di glucosio utilizzata per il mantenimento e la regolazione della glicemia, e la sua degradazione si verifica principalmente:
- durante il digiuno, ad esempio di notte;
- nell’intervallo tra i pasti;
- durante l’attività fisica intensa.
La glicogenolisi in questa sede è stimolata dal glucagone e dall’adrenalina, inibita dall’insulina, e soggetta anche a regolazione allosterica negativa da parte del glucosio.
Nel muscolo, il glicogeno è una riserva di energia per l’attività, Infatti la sua degradazione avviene solamente durante la contrazione muscolare e non interessa i muscoli che non lavorano. E’ stimolata dall’adrenalina, e regolata da effettori allosterici sia positivi che negativi, rispettivamente AMP e ione calcio, e ATP e glucosio-6-fosfato.
Indice
- Reazioni della glicogenolisi
- Regolazione covalente nel muscolo e fegato
- Regolazione allosterica nel muscolo e fegato
- Bibliografia
Reazioni della glicogenolisi
La glicogenolisi ha inizio per azione dell’enzima glicogeno fosforilasi (EC 2.4.1.1), un omodimero che per la sua attività necessita della presenza del piridossal-5’-fosfato, un derivato della piridossina o vitamina B6.
La glicogeno fosforilasi catalizza la scissione fosforolitica di un legame α-(1,4) glicosidico, con liberazione di una molecola di glucosio alla volta dalle estremità non riducenti, ossia le terminazioni con un gruppo 4’-OH libero, delle ramificazioni esterne. Questa reazione, che non consuma ATP ma un ortofosfato, produce glucosio-1-fosfato.
Glicogeno(n residui di glucosio) + Pi → Glucosio-1-fosfato + Glicogeno
Nota: nell’intestino tenue l’alfa-amilasi pancreatica (EC 3.2.1.1) catalizza la scissione idrolitica dello legame α-(1,4) glicosidico dell’amido, liberando unità di glucosio.
In vivo, la glicogeno fosforilasi catalizza una fosforolisi irreversibile, una reazione particolarmente vantaggiosa per il muscolo, sia scheletrico che cardiaco. La irreversibilità è assicurata dal rapporto [Pi]/[glucosio-1-fosfato] che normalmente è maggiore di 100; la reazione è invece facilmente reversibile in vitro.
L’enzima agisce ripetutamente all’estremità non riducente della ramificazione, ma la sua attività cessa a 4 residui di distanza dal punto di ramificazione stesso: questo rappresenta il limite esterno della destrina limite.
A questo punto intervengono in sequenza due attività enzimatiche presenti sulla stessa catena polipeptidica: l’alfa-(1,4)-glucan-6-glicosiltransferasi (EC 2.4.1.25) e l’amilo-alfa-(1,6)-glucosidasi o enzima deramificante (EC 3.2.1.33).
La prima trasferisce tre delle quattro molecole di glucosio rimaste dalla ramificazione in questione all’estremità non riducente di un’altra ramificazione. Pertanto della catena laterale formata da 4 residui di glucosio ne rimane solo uno, legato alla catena principale da un legame α-(1,6) glicosidico.
La seconda attività enzimatica idrolizza questo legame α-(1,6) glicosidico, liberando glucosio e producendo una catena non ramificata formata da unità di glucosio legate da legame α-(1,4) glicosidico.
Eliminata la ramificazione, la glicogeno fosforilasi può riprendere la sua attività sino al raggiungimento della successiva destrina limite.
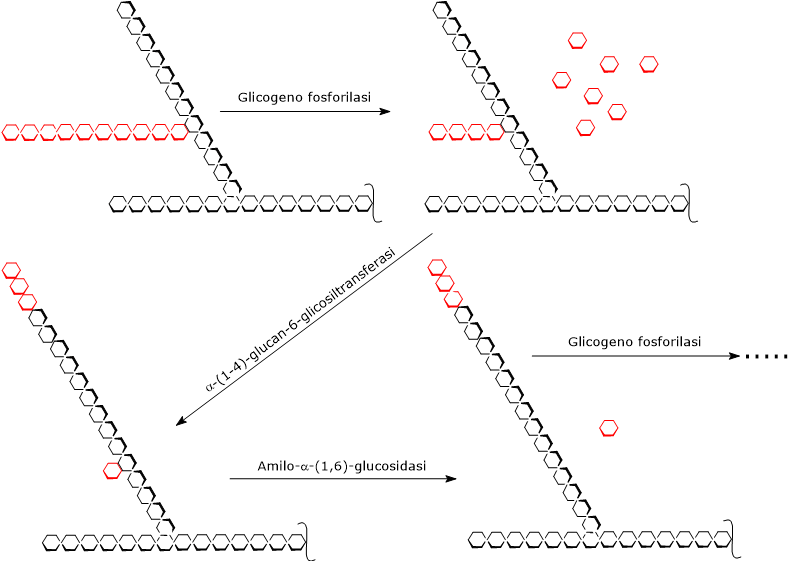
Quindi i prodotti della reazione catalizzata dalle tre attività enzimatiche sono:
- glucosio-1-fosfato, circa il 90%;
- una piccola quantità di glucosio libero, il restante 10% (si tratta dei residui legati tramite legame α-(1,6) glicosidico; nel muscolo l’attività della esochinasi (EC 7.1.1), il primo enzima della via glicolitica, è così elevata che tutto il glucosio liberato è immediatamente fosforilato a glucosio-6-fosfato, e dunque attivato, e metabolizzato all’interno della cellula);
- una molecola di glicogeno con dimensioni e ramificazioni minori.
Metabolismo del glucosio-1-fosfato nel muscolo e fegato
Il glucosio-1-fosfato è una molecola dotata di carica, e pertanto intrappolata all’interno della cellula.
E’ convertito in glucosio-6-fosfato nella reazione catalizzata dalla fosfoglucomutasi (EC 5.4.2.2), lo stesso enzima che interviene anche nella sintesi del glicogeno convertendo il glucosio-6-fosfato a glucosio-1-fosfato. L’enzima catalizza una reazione reversibili: la direzione è determinata dalle concentrazioni relative delle due molecole, e in questo caso sposta il gruppo fosfato dal C1 al C6.
Glucosio-1-fosfato ⇄ Glucosio-6-fosfato
Nel muscolo, e nella maggior parte degli altri organi e tessuti, il glucosio derivante dalla glicogenolisi entra nella via glicolitica come glucosio-6-fosfato, bypassando così il passaggio iniziale di attivazione catalizzato della esochinasi. Quindi, la glicogeno fosforilasi, liberando un’unità di glucosio già “attivata”, permette il risparmio di una molecola di ATP. Una molecola di ATP è richiesta per produrre un successivo intermedio della via glicolitica: il fruttosio-1,6-bisfosfato. In questo modo si conserva una parte dell’energia di attivazione spesa per la sintesi del glicogeno: il guadagno netto per molecola di glucosio nella glicolisi anaerobica sarà non di due ma di tre molecole di ATP, un vantaggio per il muscolo durante l’esercizio. L’equazione complessiva è:
Glicogeno(n residui di glucosio) + 3 ADP + 3 Pi → Glicogeno(n-1 residui di glucosio) + 2 Lattato + 3 ATP
Nel fegato, il glucosio-6-fosfato proveniente dalla glicogenolisi è defosforilato nella reazione catalizzata dalla glucosio-6-fosfatasi (EC 3.1.3.9), e quindi rilasciato nel circolo ematico.
Considerando i singoli passaggi che intervengono nella rimozione di una molecola di glucosio in forma fosforilata dal glicogeno si ha:
Glicogeno(n residui di glucosio) + Pi → Glucosio-1-fosfato + Glicogeno(n-1 residui di glucosio)
Glucosio-1-fosfato → Glucosio-6-fosfato
Glucosio-6-fosfato + H2O → Glucosio + Pi
L’equazione complessiva è:
Glicogeno(n residui di glucosio) + H2O → Glicogeno(n-1 residui di glucosio) + Glucosio
Regolazione covalente nel muscolo e fegato
La glicogenolisi è soggetta ad un fine controllo attraverso modificazioni sia covalenti che allosteriche di alcuni enzimi chiave, tra cui la fosforilasi chinasi (EC 2.7.11.19), la glicogeno fosforilasi e la fosfoprotein fosfatasi 1.
Di seguito sono analizzati gli effetti di due ormoni che agiscono attraverso fosforilazione di specifiche proteine bersaglio:
- l’adrenalina o epinefrina, prodotta dalle ghiandole surrenali, che agisce ad esempio sulle cellule epatiche, muscolari e del tessuto adiposo;
- il glucagone, prodotto dalle cellule alfa del pancreas endocrino, che agisce sugli epatociti e gli adipociti.
Questi ormoni, legandosi ai rispettivi recettori di membrana, innescano una identica cascata di reazioni intracellulari che determina un’amplificazione di diversi ordini di grandezza del segnale da essi trasportato.
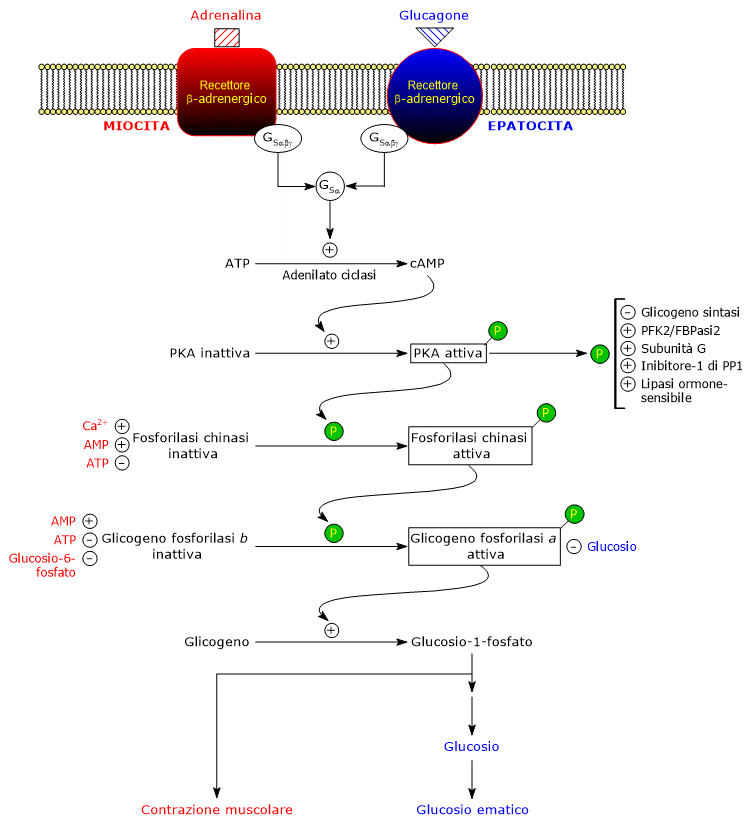
Da notare che anche l’acetilcolina, a seguito del legame agli specifici recettori presenti a livello delle giunzioni neuromuscolari, innesca la stessa cascata di attivazioni dell’adrenalina e glucagone.
Nei paragrafi successivi verranno prese in esame le proteine coinvolte nella cascata.
Recettori beta-adrenergici
I recettori per l’adrenalina e il glucagone sono proteine integrali di membrana, che attraversano la membrana con 7 α-eliche.
Tali recettori sono definiti “adrenergici”, dal nome dell’ormone adrenalina, e ne esistono 4 sottotipi: alfa1, alfa2, beta1 e beta2. Nella discussione successiva saranno considerati solo i beta1 e beta2, indicati come beta, che comunque agiscono allo stesso modo.
I recettori beta mediano i cambiamenti del metabolismo energetico, compresa oltre alla glicogenolisi nelle cellule muscolari ed epatiche, anche la lipolisi, ossia la demolizione dei trigliceridi, nel tessuto adiposo.
Proteina G stimolatoria
Il legame dell’ormone al recettore determina modificazioni conformazionali nella porzione citosolica del recettore stesso, in conseguenza delle quali si modifica la sua interazione con la seconda proteina della cascata: la proteina stimolatoria legante i nucleotidi guaninici, o più semplicemente proteina G stimolatoria (GS). Si tratta di un eterotrimero formato da tre subunità, indicate come alfa, la subunità legante i nucleotidi, beta, e gamma. Nella forma inattiva, GSαβγ-GDP, l’eterotrimero è associato al recettore beta-adrenergico.
Le modificazioni conformazionali subite dal recettore gli consentono di catalizzare la sostituzione del GDP con il GTP nella subunità α di GSαβγ.
Come conseguenza di ciò GSα, con il GTP legato, ossia la forma attivata di GS, si dissocia dal dimero beta-gamma e si sposta lungo la superficie interna della membrana plasmatica, cui è ancorata da un gruppo palmitoilico che lega con legame covalente, sino a raggiungere una molecola vicina di adenilato ciclasi (EC 4.6.1.1).
Nota: l’azione della GS ricorda quelle delle proteine Ras, un’altra classe di proteine G, che interviene nella trasduzione del segnale trasportato dall’insulina.
Adenilato ciclasi
E’ un enzima integrale di membrana il cui sito attivo si apre nel citosol.
A seguito del legame con GSα l’enzima passa in forma attiva e catalizza la sintesi di cAMP a partire da ATP, determinando quindi un aumento della concentrazione intracellulare del nucleotide ciclico.
L’attività stimolatoria di GSα è autolimitante in quanto è essa stessa una GPTasi, ossia è capace di idrolizzare il GTP in GDP inattivandosi. Nella forma inattiva GSα si dissocia dalla adenilato ciclasi e si riassocia al dimero Gβγ; in questo modo GS è di nuovo disponibile ad interagire con il complesso recettore-ormone.
Protein chinasi A
Il cAMP si va a legare alla protein chinasi cAMP-dipendente o protein chinasi A o PKA (EC 2.7.11.11), attivandola.
La forma inattiva dell’enzima è un tetramero formato da due subunità catalitiche e due regolatorie. Ognuna delle due subunità regolatorie possiede un dominio autoinibitorio, ossia una regione che va ad occupare il sito di legame per il substrato di ciascuna subunità catalitica. Il legame di due molecole di cAMP a due siti su ciascuna subunità regolatoria determina nelle stesse una modificazione conformazionale in conseguenza della quale si dissociano dal tetramero, lasciando le due subunità catalitiche in forma attiva.
La forma attiva di PKA catalizza la fosforilazione di specifici residui aminoacidici su diverse proteine, attivandone od inibendole l’attività. Tra le proteine bersaglio si ritrovano:
- glicogeno sintasi (EC 2.4.1.11), inibita;
- lipasi ormone-sensibile (EC 3.1.1.79), attivata;
- fosfofruttochinasi 2/fruttosio-2,6-bisfosfatasi (rispettivamente EC 2.7.1.105 ed EC 3.1.3.46), attivate;
- inibitore-1 e la subunità G, da glycogen-binding, ossia legante il glicogeno, della protein fosfatasi 1, attivate;
- fosforilasi chinasi, attivata.
L’emivita del cAMP è molto breve. Il nucleotide ciclico è convertito in AMP, inattivo come secondo messaggero, nella reazione catalizzata dalla nucleotide ciclico fosfodiesterasi (EC 3.1.4.53). La caffeina e la teofillina, due metilxantine presenti rispettivamente nel caffè e nel tè, inibiscono l’azione della suddetta fosfodiesterasi, aumentando quindi l’emivita del cAMP, e potenziando l’effetto indotto dagli stimolatori della adenilato ciclasi.
Fosforilasi chinasi
Il passaggio successivo della cascata di attivazioni è operato dalla fosforilasi chinasi.
La proteina è formata da 4 diverse subunità, ognuna delle quali è presente con quattro copie, a formare un complesso indicato come (αβγδ)4.
Le subunità gamma hanno attività catalitica, mentre le altre sono subunità regolatorie.
Le subunità alfa e beta sono quelle che vengono fosforilate nel passaggio dalla forma inattiva a quella attiva.
La subunità delta, anche detta calmodulina, è una proteina regolatoria in grado di legare il calcio. Si tratta di una proteina non esclusiva della fosforilasi chinasi, ma presente nella cellula legata anche ad altri complessi enzimatici. La calmodulina agisce come recettore per il calcio, risponde cioè alle variazioni intracellulari della concentrazione dello ione, influenzando di conseguenza l’attività delle proteine con cui interagisce.
Esistono due isoforme della fosforilasi chinasi, una espressa nel muscolo scheletrico e cardiaco e l’altra nel fegato, che differiscono riguardo alle subunità alfa e gamma, che sono codificate da geni differenti.
Uno dei bersagli della fosforilasi chinasi attivata è la glicogeno fosforilasi, che è presente in forme isoenzimatiche diverse in differenti tessuti, e può esistere in due stati conformazionali in equilibrio tra di loro indicati come:
- T, che sta per tense o taut, e che è meno attivo;
- R, che sta per relaxed, che è più attivo e capace di legarsi ai granuli di glicogeno, anche nello stato fosforilato.
La fosforilasi chinasi andrà a fosforilare un residuo di serina (Ser-14) in ognuna delle due subunità della glicogeno fosforilasi, che in forma defosforilata è quasi interamente nella conformazione T, convertendola nella forma attiva, che al contrario è quasi interamente nella conformazione R, ed innescando quindi la glicogenolisi.
L’enzima fosforilato è la forma più attiva dell’enzima, ed è detta glicogeno fosforilasi a; la proteina non fosforilata è la forma meno attiva, ed è detta glicogeno fosforilasi b. Ognuna delle due forme enzimatiche può essere attivata od inibita allostericamente.
Nel muscolo la glicogenolisi libererà glucosio-1-fosfato che, come visto, sarà utilizzato dal muscolo stesso per ricavare l’energia necessaria alla contrazione muscolare, e dunque per sostenere la reazione di lotta o fuga innescata dall’adrenalina.
Nel fegato si otterrà invece l’immissione in circolo di glucosio per contrapporsi all’ipoglicemia segnalata dal glucagone.
Terminata la situazione stressante, la fosforilasi fosfatasi o fosfoprotein fosfatasi 1 o PP1, acronimo dell’inglese phosphoprotein phosphatase 1 (EC 3.1.3.17), catalizza la rimozione dei gruppi fosforici dalla fosforilasi chinasi e dalla glicogeno fosforilasi a, convertendole così nelle forme inattive. L’enzima rimuove i gruppo fosfato anche dalla glicogeno sintasi. PP1 è formata da una subunità catalitica, di per se inefficiente in quanto dotata di bassa affinità per le particelle di glicogeno, e dalla subunità G, che appartiene ad una famiglia di proteine che legano altre proteine ai granuli di glicogeno, definite in inglese come glycogen-targeting proteins.
Si noti che anche la fosforilasi chinasi, la glicogeno fosforilasi, e la glicogeno sintasi sono ancorate ai granuli di glicogeno da proteine appartenenti a questa famiglia.
PP1 è inibita anche da un’altra proteina detta inibitore 1.
Come visto in precedenza, PKA è in grado di fosforilare:
- la subunità G, che quando è fosforilata da PKA non è in grado di legarsi alla subunità catalitica di PP1, che quindi a sua volta non è in grado di incontrare i suoi substrati legati al glicogeno (di contro la fosforilazione indotta dall’insulina, interessando residui aminoacidici diversi dai precedenti, permette il legame a PP1);
- l’inibitore 1, che in forma fosforilata blocca PP1.
Quindi a seguito del legame dell’ormone al recettore si innesca una cascata di reazioni che, tra le altre cose, determina l’inattivazione di PP1. Questo mantiene fosforilate sia la glicogeno fosforilasi, che è nella sua forma attivata, che la glicogeno sintasi, al contrario nella sua forma inattivata. In questo modo si ottimizza il metabolismo dei carboidrati.
Regolazione allosterica nel muscolo e fegato
La glicogenolisi è soggetta anche al controllo da parte di effettori allosterici sia positivi che negativi. La fosforilasi chinasi muscolare, la glicogeno fosforilasi epatica e muscolare, e PP1 sono i bersagli di queste regolazioni allosteriche.
Fosforilasi chinasi del muscolo
L’enzima è soggetto all’azione di due effettori allosterici positivi, lo ione calcio e l’AMP, ed uno negativo, l’ATP.
Un aumento nella concentrazione intracellulare dello ione calcio è il segnale per la contrazione muscolare e, una volta rilasciato dal reticolo sarcoplasmatico, si lega alla subunità delta, ossia la calmodulina, dell’enzima attivandolo.
L’AMP si accumula nel muscolo in contrazione vigorosa, a causa del consumo di ATP, ed è in grado di legarsi, attivandolo, all’enzima.
Al contrario, quando l’ATP è presente in concentrazione adeguata, dunque il muscolo non si sta contraendo, lo stesso si lega al sito allosterico cui si lega anche l’AMP, inattivando la chinasi.
Fosforilasi chinasi del fegato
Alcuni ormoni possono agire non solo innescando modificazioni covalenti di proteine bersaglio, ma anche attraverso il rilascio di calcio dal reticolo endoplasmatico.
Nel fegato l’attività della fosforilasi chinasi è regolata da ormoni che determinano il rilascio di ioni calcio. Esempi sono la vasopressina, ma anche l’adrenalina quando si lega ai recettori α1 adrenergici. Considerando adrenalina, il suo legame al suddetto recettore attiva una proteina G che stimola la fosfolipasi C-β, che a sua volta scinde il fosfatidilinositolo-4,5-disfosfato in inositolo 1,4,5-trifosfato (IP3) e diacilglicerolo. L’inositolo 1,4,5-trifosfato induce il rilascio di ioni calcio dal reticolo endoplasmatico. Il calcio legandosi alla subunità δ della fosforilasi chinasi ne determina l’attivazione.
Glicogeno fosforilasi del muscolo
Nel muscolo la glicogeno fosforilasi b si attiva in presenza di elevate concentrazione di AMP, che, legandosi ad uno specifico sito di legame per i nucleotidi, modifica la struttura quaternaria dell’enzima, spostando l’equilibrio allosterico verso lo stato R, attivo, della forma b.
Al contrario, ATP ed glucosio-6-fosfato, che competono per lo stesso sito di legame con l’AMP, agiscono come effettori allosterici negativi, spostando l’equilibrio allosterico verso lo stato T inattiva della forma b.
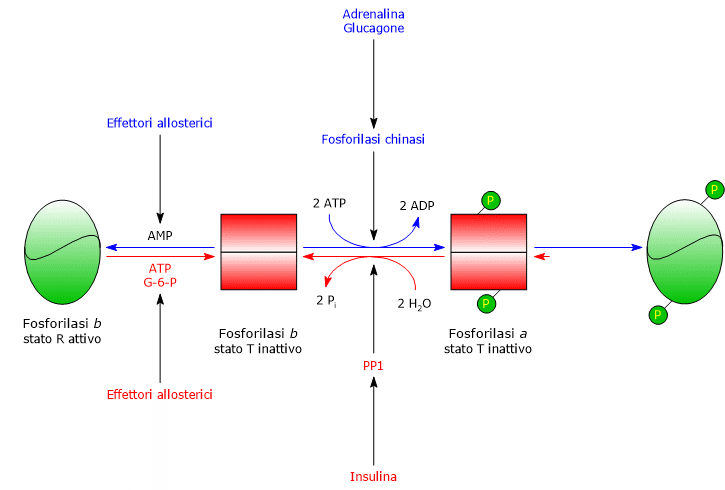
Al contrario, la glicogeno fosforilasi a, a prescindere dai livelli di AMP, ATP e glucosio-6-fosfato, è attiva.
Nel muscolo a riposo, la glicogeno fosforilasi è praticamente tutta nella forma b inattiva.
La duplice regolazione cui è soggetto l’enzima, covalente ed appunto allosterica, assicura che i livelli intracellulari di glucosio siano regolati finemente.
- Se una cellula che possegga una adeguata carica energetica riceve il segnale ormonale che innesca la cascata di attivazioni, la fosforilasi b, inibita dall’ATP e dal glucosio-6-fosfato, rimane nello stato T inattivo finché la carica energetica è alta.
- Se la carica energetica della cellula è bassa, la glicogeno fosforilasi b, attivata dall’AMP, inizia la demolizione del glicogeno, anche in assenza dello stimolo ormonale che induca la sua conversione nella forma a.
Regolazione allosterica di PP1
Anche PP1 è allostericamente attivata dal glucosio-6-fosfato, quindi quando la carica energetica della cellula è bassa.
Glicogeno fosforilasi del fegato
Nel fegato la regolazione allosterica dell’enzima segue vie diverse.
- La prima differenza riguarda la risposta all’AMP: la glicogeno fosforilasi b epatica non è attivata dall’AMP.
- La seconda differenza riguarda la glicogeno fosforilasi a: l’enzima è inattivato dal legame con il glucosio, in quanto il monosaccaride sposta l’equilibrio allosterico verso lo stato T inattivo della forma a.
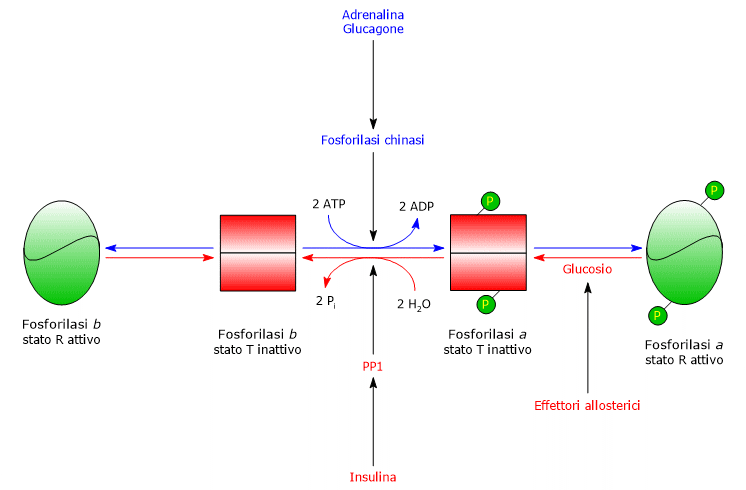
Nel fegato, lo scopo della glicogenolisi è quello di fornire glucosio agli altri tessuti quando la glicemia è bassa.
Quando la glicemia è tornata a valori normali, la concentrazione del monosaccaride nell’epatocita aumenta, e lo stesso si va legare ad un sito accessibile sulla glicogeno fosforilasi a, inducendone un cambiamento conformazionale che espone i residui di serina fosforilati all’azione di PP1, che defosforilando l’enzima lo inattiva. Quindi il sito allosterico per il legame del glucosio presente sulla glicogeno fosforilasi epatica permette all’enzima epatico di agire come un sensore della glicemia, rispondendo in modo appropriato alle sue variazioni.
In definitiva l’enzima epatico risponde al glucosio e non all’AMP, alla carica energetica cellulare, e questo è metabolicamente importante in quanto il glucosio non è il combustibile principale del fegato, ma lo sono gli acidi grassi.
Bibliografia
- Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 6th Edition. W.H. Freeman and Company, 2012
- Roach P.J., Depaoli-Roach A.A., Hurley T.D., Tagliabracci V.S. Glycogen and its metabolism: some new developments and old themes. Biochem J 2012:441;763-787. doi:10.1042/BJ20111416
- Rosenthal M.D., Glew R.H. Medical Biochemistry – Human Metabolism in Health and Disease. John Wiley J. & Sons, Inc., Publication, 2009