Il lattosio o zucchero di latte o beta-D-galattopiranosil-(1→4)-D-glucosio è un disaccaride formato da una molecola di beta-D-galattosio e una di D-glucosio, entrambe in forma piranosica. I due monosaccaridi sono uniti da un legame glicosidico β-(1→4). Poiché il glucosio conserva un carbonio emiacetalico, il lattosio è uno è uno zucchero riducente e ha due forme anomeriche, indicate come alfa e beta.[12]
Viene prodotto dalle cellule epiteliali della ghiandola mammaria nel corso dell’allattamento, in una reazione di condensazione tra l’UDP-galattosio e il glucosio.[1] La reazione è catalizzata dal complesso della lattosio sintetasi (EC 2.4.1.22), un eterodimero formato dalla alfa-lattoalbumina e dalla beta-1,4-galattosil transferasi 1 (EC 2.4.1.38).[9]
Nell’adulto costituisce il 5-10% dei carboidrati alimentari e, con l’amido e il saccarosio, è uno dei tre più comuni carboidrati assunti con la dieta.[11]
Nel duodeno e digiuno, grazie alla presenza della lattasi (EC 3.2.1.108), una idrolasi dell’orletto a spazzola degli enterociti, il legame glicosidico β-(1→4) del lattosio viene idrolizzato, con liberazione di glucosio e galattosio.[17]
La condizione in cui l’attività lattasica non è sufficiente a digerire il lattosio assunto con la dieta viene definita ipolattasia o deficit di lattasi, determina malassorbimento del disaccaride e può essere accompagnata dalla sindrome da intolleranza al lattosio, una condizione riconosciuta solo negli ultimi 50 anni e la principale intolleranza alimentare che interessa l’uomo.[5]
Il lattosio svolge diverse funzioni, come fornire circa il 40% dell’energia che il lattante ricava dal latte materno ed essere una fonte di galattosio, monosaccaride essenziale nella biosintesi di macromolecole glicosilate indispensabili per il corretto sviluppo del sistema nervoso.[3]
E’ presente nei latticini in quantità inversamente correlate al grado di stagionatura del prodotto.[4]
Trova utilizzo, tra gli additivi, nell’industria alimentare e farmaceutica.[15][16]
Indice
- Proprietà chimiche
- Biosintesi
- Fonti alimentari
- Digestione del lattosio
- Funzioni
- Ipolattasia
- Bibliografia
Proprietà chimiche
Al pari dei disaccaridi saccarosio, maltosio e trealosio ha formula molecolare C12H22O11 e massa molare di 342,30 g/mol.[12]
E’ meno solubile rispetto agli altri disaccaridi, e ha una dolcezza pari al 16% di quella del saccarosio.
Il legame glicosidico tra galattosio e glucosio ha configurazione beta, ossia il legame dal carbonio anomerico del galattosio è rivolto verso l’alto rispetto al piano formato dalla molecola del galattosio. Da notare che il legame glicosidico β-(1→4) si ritrova anche nella cellulosa e nella chitina.[16]
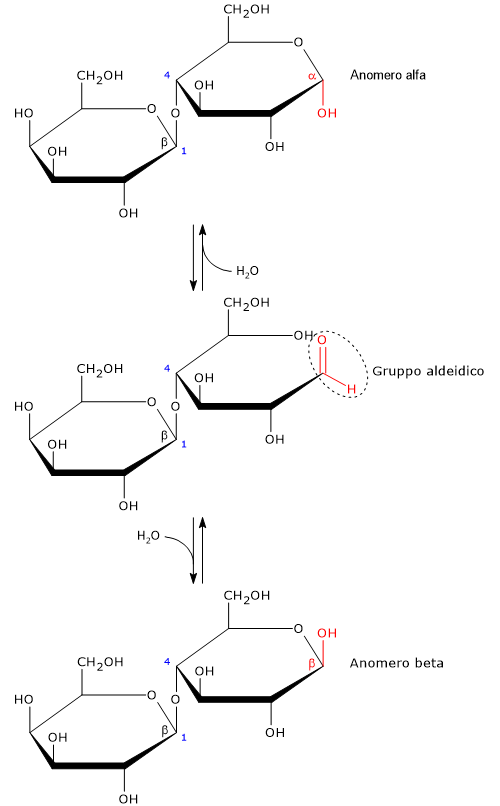
Come tutti i monosaccaridi, e il maltosio tra i disaccaridi, è uno zucchero riducente in quanto il legame glicosidico β-(1→4) non intersessa il carbonio emiacetalico (anomerico) del glucosio; pertanto, in soluzione l’anello del glucosio potrà aprirsi presentando un gruppo aldeidico.[13]
La forma a catena aperta del glucosio è termodinamicamente sfavorita, ed è presente solo in tracce in soluzione, meno dello 0,02%. Alla chiusura dell’anello si possono avere due configurazione cicliche piranosiche, che differiscono nella configurazione del carbonio emiacetalico. Questo fenomeno viene definito mutarotazione, mentre gli isomeri risultanti sono indicati come anomeri alfa e beta. In soluzione, a 20 °C l’anomero prevalente è quello beta, con circa il 67%, sebbene l’equilibrio cambi in funzione della temperatura. A temperature >93,5 °C è presente solo l’anomero beta.[8]
L’anomeria è un tipo di isomeria ottica caratteristica dei carboidrati, dove lo zucchero ciclico differisce solo nella conformazione del carbonio emiacetalico o emichetalico, che è definito anomerico.
Biosintesi
Il lattosio viene prodotto dalle cellule epiteliali della ghiandola mammaria in una reazione catalizzata dal complesso della lattosio sintasi, un eterodimero presente nell’apparato di Golgi e formato dal legame tra la alfa-lattoalbumina e la beta-1,4-galattosil transferasi 1 (EC 2.4.1.38), proteina intrinseca della membrana dell’apparato di Golgi, in un rapporto 1:1.[9] Questa interazione proteina-proteina è reversibile ed è promossa dai monosaccaridi e dall’UDP-galattosio.[24]
Il complesso catalizza una reazione tra l’UDP-galattosio e il glucosio, con trasferimento del galattosio al glucosio e formazione di un legame glicosidico β-(1→4) tra il C1 del galattosio e l’atomo di ossigeno del gruppo ossidrilico legato al C4 del glucosio.[1]
Il glucosio è il principale precursore dei monosaccaridi che compongono il lattosio, rispettivamente di tutto il glucosio e di circa il 70% del galattosio.
La formazione del complesso tra la beta-1,4-galattosil transferasi 1 e l’alfa-lattoalbumina avviene nel lume dell’apparato di Golgi. L’alfa-lattoalbumina, una proteina secretoria, in una fase del suo tragitto all’interno della cellula diviene una componente solubile e transiente del contenuto del lume dell’apparato di Golgi, ed è in questa fase che si lega reversibilmente alla beta-1,4-galattosil transferasi 1. E la natura transitoria dell’interazione tra l’alfa-lattoalbumina e la galattosil transferasi assicura un legame tra la sintesi delle proteine del latte e quella del lattosio nel corso dell’allattamento.[24]
Il lattosio non può attraversare la membrana dell’apparato di Golgi, e, con l’alfa-lattoalbumina, lascia la cellula epiteliale della ghiandola mammaria attraverso vacuoli secretori il cui contenuto viene rilasciato all’esterno per esocitosi.[2]
Alfa-lattoalbumina
La lattoalbumina è una delle principali proteine del siero del latte, è cataliticamente inattiva, ed esiste in due forme: l’alfa-lattoalbumina, che è la forma prevalente nel latte umano, e la beta-lattoalbumina, prevalente invece nel latte dei Ruminanti, in particolare in quello vaccino.
La sintesi del lattosio richiede la presenza della alfa-lattoalbumina, e la trascrizione del suo gene è regolata dall’ormone prolattina o ormone luteotropo. Quello che accade è che dopo il parto la riduzione dei livelli di progesterone determina un aumento della sintesi di prolattina, che, a livello delle cellule epiteliali della ghiandola mammaria stimola la sintesi della alfa-lattoalbumina, e di conseguenza la formazione del complesso della lattosio sintasi.
Se invece si considera la ghiandola mammaria non in lattazione, l’alfa-lattoalbumina non viene prodotta, il complesso della lattosio sintasi non si forma e il lattosio non è prodotto.[14]
Beta-1,4-galattosil transferasi 1
Nei mammiferi la beta-1,4-galattosil transferasi 1 fa parte di un gruppo di sette galattosil transferasi che catalizzano la formazione di legami glicosidici β-(1→4) tra il galattosio e differenti accettori.[24]
E’ espressa nella maggior parte dei tessuti dove catalizza l’addizione del galattosio al gruppo 4-ossidrile di un residuo di N-acetil-β-D-glucosammina terminale non riducente di glicoproteine e glicolipidi.[14]
La beta-1,4-galattosil transferasi 1 ha una bassa affinità per il glucosio, con una Km di circa 2 mol/L.[2] Nel corso della gravidanza l’enzima viene prodotto e immagazzinato nelle cellule epiteliali della ghiandola mammaria. Il successivo legame con l’alfa-lattoalbumina innesca modificazioni conformazionali a carico della regione del sito attivo a seguito delle quali l’affinità dell’enzima per il glucosio aumenta di circa 1000 volte, e quindi la Km per il monosaccaride passa a circa 2 mmol/L. Ciò permette, a concentrazioni fisiologiche del glucosio, la sintesi preferenziale ed efficiente del lattosio rispetto alla galattosilazione di altri accettori.[24]
Fonti alimentari
Il lattosio è contenuto nel latte di quasi tutte le specie di mammifero, sebbene in quantità differenti tra le diverse specie. Ad esempio rappresenta rispettivamente circa il 7,5% e il 4,5% della composizione del latte della donna e della mucca.[6] La sua concentrazione nel corso dell’allattamento rimane invece relativamente stabile.[7]
E’ assente nel latte di poche specie di mammiferi, ad esempio diversi appartenenti alla famiglia delle Otariidae, come l’otaria del Capo (Arctocephalus pusillus pusillus) o il leone marino della California (Zalophus californianus), o alla famiglia delle Phocidae come la foca dal cappuccio (Cystophora cristata). Nell’otaria del Capo, la capacità di produrre lattosio è stata perduta a seguito di mutazioni a carico del gene per l’alfa-lattoalbumina risultanti nell’assenza della proteina.[19]
Nei prodotti caseari è presente in quantità variabili e inversamente proporzionali al grado di stagionatura. Quindi prodotti come yogurt o la ricotta ne hanno le quantità maggiori, mentre i formaggi a pasta dura presentano i livelli più bassi, in molti casi prossimi allo zero, come nel caso del Parmigiano Reggiano.[4]
E’ presente in quantità estremamente elevate in prodotti come il latte in polvere, e nel siero di latte in polvere.[15]
| Alimento (100 g) | Lattosio (g) |
| Latte umano | 7,5 |
| Latte vaccino intero | 4,8 |
| Latte vaccino parzialmente scremato | 4,9 |
| Latte vaccino scremato | 4,9 |
| Latte intero in polvere | 35,1 |
| Latte scremato in polvere | 50,5 |
| Siero di latte in polvere | 58-62 |
| Latte di bufala | 4,9 |
| Latte di capra | 4,2 |
| Yogurt | 3-4 |
| Ricotta vaccina | 4,0 |
| Formaggini | 6 |
| Formaggi freschi come mozzarella, crescenza o caprino | 1-3 |
| Emmenthal e formaggi a pasta semidura | 0,1 |
| Parmigiano Reggiano, Grana Padano e formaggi a pasta dura | 0 |
Si ritrova in prodotti quali caramelle, cioccolato, cereali da prima colazione, prodotti da forno e salumi, dove viene utilizzato come additivo alimentare.[4]
Anche l’industria farmaceutica ricorre al suo utilizzo, sebbene in concentrazioni dell’ordine dei milligrammi, nella produzione di pasticche e di inalatori.[15]
Digestione del lattosio
Nell’uomo, e nei mammiferi in generale, la digestione dei carboidrati avviene principalmente nel duodeno e nel digiuno. L’alfa-amilasi pancreatica e le disaccaridasi dell’orletto a spazzola degli enterociti idrolizzano polisaccaridi, oligosaccaridi e disaccaridi nei monosaccaridi costituenti, ovvero glucosio, galattosio e fruttosio. Segue quindi, sempre nell’intestino tenue, l’assorbimento dei monosaccaridi rilasciati.[17]
L’enzima responsabile dell’idrolisi del legame glicosidico β-(1→4) del lattosio è la lattasi o lattasi-florizin idrolasi. In condizioni fisiologiche è presente alla nascita in tutti i soggetti, essendo cruciale per la digestione del lattosio.[23] L’enzima ha due siti attivi:
- uno in grado di idrolizzare il legame glicosidico β-(1→4), dunque una beta-glucosidasi;
- l’altro con attività florizin idrolasica, in grado di idrolizzare la florizina e glicolipidi, come le ceramidi a dare acidi grassi e sfingosina.
La lattasi è presente abbondantemente nella porzione mediana del digiuno, e, tra le idrolasi dell’orletto a spazzola degli enterociti è l’unica in grado di idrolizzare il legame glicosidico β-(1→4) del lattosio.[21]
Tra le disaccaridasi è l’ultima ad apparire nel corso della vita fetale, intorno all’ottava settimana dal concepimento. Alla trentaquattresima settimana è presente circa un terzo dell’attività lattasica rilevata a fine gestazione, mentre tra la trentacinquesima e la trentottesima settimana si raggiungono i tre quarti. In quasi tutti i bambini a termine sia la sintesi che l’attività lattasica sono elevate e rimangono tali durante i primi quattro anni di vita.[20]
Poiché viene espressa tardi nel corso dello sviluppo degli enterociti, quando gli stessi hanno quasi raggiunto l’estremità del villo, e poiché l’enzima protrude dalla membrana spesso è il primo a essere perso nelle malattie intestinali.[20]
Funzioni
ll lattosio svolge diverse funzioni, sia anaboliche che cataboliche.
Funge da fonte di energia fornendo circa il 40% di quella che il lattante ricava dal latte materno.[18] Infatti il glucosio da esso ottenuto può entrare nella glicolisi ed essere utilizzato per la produzione di ATP. Quando invece le condizioni metaboliche non lo richiedono, può essere utilizzato a scopi anabolici, ad esempio per la sintesi degli acidi grassi, e quindi dei trigliceridi.
Di contro, il galattosio ha prevalentemente un ruolo anabolico. Una volta raggiunto il fegato, entra nella via di Leloir e, convertito in UDP-glucosio, è utilizzato per la sintesi del glicogeno.[3] Sebbene in teoria anche il glucosio-1-fosfato prodotto nella via di Leloir possa entrare nella via glicolitica, previa conversione in glucosio-6-fosfato, sembra che solamente una piccola percentuale segua questa via.
Nel neonato e nella prima infanzia il galattosio viene utilizzato nella biosintesi di macromolecole glicosilate quali mucoproteine, cerebrosidi, e gangliosidi che sono componenti delle guaine mieliniche delle cellule nervose. Quando la mielinizzazione delle fibre nervose e lo sviluppo sono terminati, anche la necessità di galattosio si riduce molto; ciò forse potrebbe spiegare dal punto di vista fisiologico la ridotta o assente capacità di molte popolazioni di digerire il lattosio già in giovane età.[3]
Il galattosio è un componente di alcuni tra gli antigeni presenti sui globuli rossi, in particolare di quelli utilizzati per determinare il gruppo sanguigno in base al sistema AB0.
Il lattosio, non potendo attraversare la membrana dell’apparato di Golgi, agisce come osmolita richiamando acqua. Questo influsso è importante per la formazione della fase acquosa del latte.[24]
Il legame dei due monosaccaridi glucosio e galattosio a dare il disaccaride riduce la pressione osmotica del latte, che è pari a quella del plasma materno.[16]
Ha un ruolo nell’assorbimento intestinale di minerali, in special modo durante l’infanzia. Infatti glucosio e galattosio sono per la maggior parte assorbiti a mezzo del trasportatore SGLT1 che cotrasporta anche sodio, acqua e calcio.[22]
L’acidificazione del latte è dovuta alla fermentazione del lattosio ad acido lattico da parte dei batteri.
Il lattosio non digerito una vota raggiunto il colon può essere metabolizzato dal microbiota intestinale, che è parte del microbiota umano, e dunque può agire da prebiotico.[11]
Ipolattasia
L’ipolattasia o deficit di lattasi, che può avere basi genetiche o essere secondaria a condizioni perturbanti gli enterociti, determina malassorbimento del lattosio che, una volta raggiunto il colon, può dare origine all’insieme di sintomi noti come sindrome da intolleranza al lattosio.[5]
Nel colon il disaccaride può essere in parte fermentato dai batteri del microbiota intestinale, con produzione di elevate quantità di gas, quali azoto e idrogeno molecolare, anidride carbonica, metano, e acidi grassi a catena corta, principalmente l’acido acetico, l’acido propionico e l’acido butirrico. Inoltre, la presenza di carboidrati non digeriti e di parte dei loro prodotti di fermentazione, soluti osmoticamente attivi, determina un aumento della pressione osmotica intraluminale e conseguente richiamo d’acqua.[11]
I sintomi che caratterizzano la sindrome da intolleranza al lattosio, conseguenti ai processi sopra descritti, sono:
- dolore addominale, dovuto sia all’acidificazione del contenuto del colon che a un effetto irritativo diretto sulla mucosa da parte acidi grassi a catena corta in eccesso;
- flatulenza, meteorismo e distensione addominale, conseguenti alla massiccia produzione di gas;
- diarrea, a seguito dell’elevato contenuto fecale in acqua, dovuto alla presenza di soluti osmoticamente attivi e alla riduzione dell’efficienza di assorbimento dell’acqua conseguente all’accelerazione dell’attività motoria del colon indotta dagli acidi grassi a catena corta in eccesso.[11]
Va notato che la cascata di eventi appena descritta è applicabile a qualsiasi zucchero che non venga assorbito nell’intestino tenue, come alle troppe fibre nella dieta.
L’ipolattasia non è sempre accompagnata dalla sindrome intolleranza al lattosio, manifestandosi quest’ultima nel 30-50% dei soggetti ipolattasici.[4] I motivi potrebbero essere diversi. E’ indubbiamente fondamentale la quantità di attività lattasica residua. Tuttavia potrebbero essere importanti anche altri fattori, di seguito brevemente descritti.
- La quantità di lattosio assunto, essendo maggiore il rischio maggiore è il carico di disaccaride.
- Il tempo di svuotamento dello stomaco, influenzato dalla composizione del pasto, essendo ad esempio i lipidi, le proteine, e le fibre in grado di rallentarlo in maniera efficace, il che permette al disaccaride di entrare nell’intestino tenue gradualmente.
- Il tempo di transito intestinale, che influenza il tempo di contatto con la lattasi, per cui alimenti in grado di rallentarlo aumenterebbero la possibilità di contatto con l’enzima.
- La composizione della flora batterica del colon che potrebbe influenzare l’entità dei processi fermentativi.
Ipolattasia primaria
In circa i tre quarti della popolazione mondiale, come nella maggior parte dei mammiferi, si verifica, dopo lo svezzamento una riduzione della biosintesi della lattasi. Questa riduzione non è conseguenza di un danno a carico del gene che codifica per l’enzima, nell’uomo presente sul cromosoma 2, ma è geneticamente programmata e trasmessa da un gene recessivo. L’attività lattasica rimanente può arrivare a valori pari al 5-10% di quelli presenti durante l’infanzia.[5]
Se ad esempio consideriamo le popolazioni mediterranee, si può osservare una riduzione dell’attività lattasica già in età giovanile, fino a valori del 90% rispetto a quella presente alla nascita. Tra i nord americani bianchi la deficienza interessa il 5-20% della popolazione, nei neri nord americani si arriva al 70-75%, tra gli asiatici i filippini raggiungono il 95% e i Thai o Tailandesi, il principale gruppo etnico della Tailandia, il 99%, come in Nigeria, Benin e Togo, tra gli Yoruba. All’opposto si ritrovano i Danesi e alcune popolazioni nomadi, consumatrici di latte, presenti nelle zone aride del Nord Africa e Arabia, in cui la deficienza interessa solo il 3% della popolazione.[5]
Quindi il declino dell’attività lattasica, definito ipolattasia primaria, non è una malattia, dovrebbe essere considerato filogeneticamente normale, e non viene modificato dall’esposizione continua al latte o al lattosio.[20]
Nella ipolattasia primaria alcuni enterociti non producono lattasi, mentre altri, anche appartenenti agli stessi villi ne producono elevate quantità. Quindi più che parlare di riduzione uniforme della produzione di lattasi sembra si abbia una distribuzione irregolare tra enterociti che non sintetizzano lattasi e quelli che la sintetizzano, che sono in numero ridotto rispetto agli altri.[10]
Sembra che la persistenza dell’attività lattasica abbia rappresentato un fattore vantaggioso per la sopravvivenza. A partire dalla diffusione dell’allevamento di animali da latte, circa 10000 anni fa, il consumo di latte e derivati, quindi l’assorbimento del lattosio, avrebbe fornito ai soggetti dotati di una adeguata attività lattasica un vantaggio per la sopravvivenza nel corso dei severi inverni del Nord Europa o in epoche di scarso raccolto.[4]
Ipolattasia secondaria
L’ipolattasia può essere secondaria a condizioni che provocano un danno agli enterociti, come infezioni intestinali, l’allergia alle proteine del latte, il morbo di Crohn a localizzazione enterale, la celiachia, ossia una reazione autoimmunitaria all’assunzione di glutine, terapie farmacologiche, chirurgia, radiazioni a carico del tratto gastrointestinale, o consumo eccessivo di alcol. In queste circostanze molte proteine dell’orletto a spazzola vengono colpite e, tra le glicosidasi, la lattasi è quella che subisce la riduzione maggiore.[5]
L’ipolattasia secondaria è una condizione piuttosto comune nei paesi del Terzo Mondo dove sono prevalenti le infezioni intestinali croniche.
Il trattamento della causa scatenante permette la guarigione dell’epitelio e il ritorno della normale attività lattasica. La completa risoluzione può richiedere fino a sei mesi, durante i quali è consigliabile astenersi dal consumo di latte e alimenti contenenti lattosio.[20]
Intolleranza congenita al lattosio
L’intolleranza congenita al lattosio è un errore congenito del metabolismo estremamente raro. E’ un carattere ereditato in maniera autosomica recessiva che si manifesta entro il primo o i primi giorni di vita.[5] L’enzima è assente o danneggiato e la sua attività non è rilevabile. Il neonato affetto può avere una grave malattia diarroica a pochi giorni dalla nascita. L’unico trattamento è una dieta priva di lattosio che elimina i sintomi e permette una normale crescita e sviluppo.[20]
Bibliografia
- ^ a b Baynes J.W., Dominiczak MH. Medical biochemistry. 5th Edition. Elsevier, 2019
- ^ a b Brew K. Milk proteins | α-Lactalbumin. Editor(s): Fuquay J.W. Encyclopedia of dairy sciences. 2nd Edition. Academic Press, 2011;780-786. doi:10.1016/B978-0-12-374407-4.00432-5
- ^ a b c Conte F., van Buuringen N., Voermans N.C., Lefeber D.J. Galactose in human metabolism, glycosylation and congenital metabolic diseases: time for a closer look. Biochim Biophys Acta Gen Subj 2021;1865(8):129898. doi:10.1016/j.bbagen.2021.129898
- ^ a b c d e Di Stefano M. Il malassorbimento e l’intolleranza al lattosio. Fisiopatologia, diagnosi e approccio terapeutico. SIMG 2012;5:40-45
- ^ a b c d e f Fassio F., Facioni M.S., Guagnini F. Lactose maldigestion, malabsorption, and intolerance: a comprehensive review with a focus on current management and future perspectives. Nutrients 2018;10(11):1599. doi:10.3390/nu10111599
- ^ Hennet T., Borsig L. Breastfed at Tiffany’s. Trends Biochem Sci 2016;41(6):508-518. doi: 10.1016/j.tibs.2016.02.008
- ^ Hovey R.C. The marvels of milk and lactation. Editor(s): Skinner M.K. Encyclopedia of reproduction. 2nd Edition. Academic Press, 2018;2:793-797. doi:10.1016/B978-0-12-801238-3.64696-2
- ^ Jawad R., Drake A.F., Elleman C., Martin G.P., Warren F.J., Perston B.B., Ellis P.R., Hassoun M.A., Royall P.G. Stability of sugar solutions: a novel study of the epimerization kinetics of lactose in water. Mol Pharm 2014;11(7):2224-38. doi:10.1021/mp400509t
- ^ a b Lin Y., Sun X., Hou X., Qu B., Gao X., Li Q. Effects of glucose on lactose synthesis in mammary epithelial cells from dairy cow. BMC Vet Res 2016;12:81. doi:10.1186/s12917-016-0704-x
- ^ Majuri L., Raja V., Potter J., Swallow D., Wan Ho M., Fiocca R., Finzi G., Cornaggia M., Capella C., Quaroni A. & Auricchio A. Mosaic pattern of lactase expression by villus enterocytes in human adult-type hypolactasia. Pediatr Res 1990;27:532. doi:10.1203/00006450-199005000-00040
- ^ a b c d Misselwitz B., Butter M., Verbeke K., Fox M.R. Update on lactose malabsorption and intolerance: pathogenesis, diagnosis and clinical management. Gut. 2019;68(11):2080-2091. doi:10.1136/gutjnl-2019-318404
- ^ a b National Center for Biotechnology Information. PubChem Compound Summary for CID 6134, beta-Lactose. https://pubchem.ncbi.nlm.nih.gov/compound/beta-Lactose. Accessed Dec. 12, 2023
- ^ Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 6th Edition. W.H. Freeman and Company, 2012
- ^ a b Palmer T., Bonner P.L.. Monomeric and oligomeric enzymes. Editor(s): Palmer T., Bonner P.L. Enzymes (2nd Edition). Woodhead Publishing. 2011;76-83. doi:10.1533/9780857099921.1.76
- ^ a b c Portnoy M., and Barbano D.M. Lactose: use, measurement, and expression of results. J Dairy Sci 2021;104(7):8314-8325. doi:10.3168/jds.2020-18706
- ^ a b c Romero-Velarde E., Delgado-Franco D., García-Gutiérrez M., Gurrola-Díaz C., Larrosa-Haro A., Montijo-Barrios E., Muskiet F., Vargas-Guerrero B., & Geurts J. The Importance of lactose in the human diet: outcomes of a mexican consensus meeting. Nutrients 2019;11(11):2737. doi:10.3390/nu11112737
- ^ a b Rosenthal M.D., Glew R.H. Medical biochemistry: human metabolism in health and disease. A John Wiley & sons, Inc., Publication, 2009
- ^ Schaafsma G. Lactose and lactose derivatives as bioactive ingredients in human nutrition. Int Dairy J 2008;18:458-465. doi:10.1016/j.idairyj.2007.11.013
- ^ Sharp J.A., Lefèvre C., Nicholas K.R. Lack of functional alpha-lactalbumin prevents involution in Cape fur seals and identifies the protein as an apoptotic milk factor in mammary gland involution. BMC Biol 2008;6:48. doi:10.1186/1741-7007-6-48
- ^ a b c d e Suarez F., Shannon C., Hertzler S., Savaiano D. Food intolerance | Lactose Intolerance. Editor(s): Caballero B. Encyclopedia of food sciences and nutrition. 2nd Edition. Academic Press, 2003;2634-2642. doi:10.1016/B0-12-227055-X/00511-3
- ^ Troelsen J.T. Adult-type hypolactasia and regulation of lactase expression. Biochim Biophys Acta. 2005 May 25;1723(1-3):19-32. doi:10.1016/j.bbagen.2005.02.003
- ^ Wright E.M., Hirayama B.A., Loo D.F. Active sugar transport in health and disease. J Intern Med 2007;261(1):32-43. doi: 10.1111/j.1365-2796.2006.01746.x. PMID: 17222166
- ^ Zecca L., Mesonero J.E., Stutz A., Poirée J.C., Giudicelli J., Cursio R., Gloor S.M., Semenza G. Intestinal lactase-phlorizin hydrolase (LPH): the two catalytic sites; the role of the pancreas in pro-LPH maturation. FEBS Lett 1998;435(2-3):225-8. doi: 10.1016/s0014-5793(98)01076-x
- ^ a b c d e Zhang Y., Brew K. Milk proteins | Alpha-Lactalbumin. Editor(s): Roginski H. Encyclopedia of dairy sciences. Elsevier, 2002;1924-1932. doi:10.1016/B0-12-227235-8/00319-9