Il trealosio è un disaccaride formato da due unità di alfa-D-glucosio unite da un legame glicosidico α-(1→1).[20]
E’ stato scoperto in un fungo della segale cornuta, genere Claviceps, da Wiggers H.A.L. nel 1832.[28] Ventisette anni dopo il lavoro di Wiggers, nel 1859, Berthelot M. lo isolò da Trehala manna, da cui il nome, una sostanza a forma di bozzolo prodotta dall’attività larvale dei tonchi della famiglia dei Curculionidae su alcune specie di Echinops.[6]
E’ uno zucchero non riducente, ed è quindi dotato di una bassa reattività chimica.[27] In Natura l’unico altro zucchero non riducente ampiamente distribuito è il saccarosio.[21]
E’ presente in tutti i principali gruppi di organismi quali batteri, funghi, lieviti, alghe, piante e invertebrati, ma è assente nei vertebrati, che mancano delle specifiche vie biosintetiche.[2]
Le fonti alimentari per l’uomo sono alcune specie di funghi, i lieviti, i crostacei, il miele, e i cibi lavorati a cui può essere aggiunto come additivo.[10]
E’ in grado di svolgere varie funzioni come deposito di carboidrati, fonte di energia, componente dei lipidi di membrana, molecola di segnalazione tra piante e microorganismi simbionti o patogeni, protezione nei confronti di stress abiotici. In forma fosforilata, nelle piante, è coinvolto nella regolazione del metabolismo dei carboidrati.[17]
I mammiferi sono in grado di utilizzare il trealosio esogeno come fonte di carbonio ed energia. La sua digestione intestinale comporta l’intervento dell’enzima trealasi (EC 3.2.1.28), in una reazione che porta alla liberazione delle due molecole di glucosio che lo compongono.
Indice
- Proprietà chimiche
- Fonti alimentari
- Biosintesi
- Trealosio nelle piante
- Funzioni
- Meccanismi molecolari del potenziale protettivo
- Digestione del trealosio
- Deficit della trealasi
- Bibliografia
Proprietà chimiche
Il trealosio, al pari dei disaccaridi lattosio, maltosio e saccarosio, ha un peso molecolare di 342,30 g/mol e formula molecolare C12H22O11.[20]
Secondo la nomenclatura IUPAC il suo nome è alfa-D-gluco-esopiranosile alfa-D-gluco-esopiranoside.
Poiché il legame glicosidico α-(1→1) interessa la funzione aldeidica di due unità di glucosio, ossia i due carboni anomerici, in soluzione non può esistere in una forma a catena aperta con un gruppo aldeidico libero, forma che sarebbe in grado di agire come agente riducente. Ne consegue che il trealosio è uno zucchero non riducente, ed è quindi dotato di una bassa reattività chimica.[27]
A temperatura ambiente si presenta come cristalli ortorombici bianchi.
Il suo punto di fusione è pari a 203 °C (397,4 °F; 476,15 K).[20]
La sua dolcezza è apri a circa il 45% di quella del saccarosio.[16]
Il trealosio fornisce circa 4 kcal/g.
Fonti alimentari
Le fonti naturali per l’uomo sono alcune specie di funghi (Amanita spp.), specialmente se giovani, i lieviti, tra gli animali i crostacei, e il miele.[10] Da quando, nel 2000, la FDA lo ha inserito tra gli additivi alimentare consentiti, e classificato, ad esempio, tra gli esaltatori di sapidità e i conservanti.[20] E, poiché è presente in piccole quantità in pochi alimenti non lavorati, i cibi lavorati ne sono diventati la principale fonte.
Biosintesi
Sono state identificate cinque vie di biosintesi nei procarioti, di cui solamente una, che è probabilmente anche la più comune, è presente anche negli eucarioti, si compone di due passaggi ed è descritta di seguito.[4]
Nel primo passaggio, catalizzato dalla trealosio-6-fosfato sintasi (EC 2.4.1.15), la condensazione dell’UDP-glucosio e del glucosio-6-fosfato porta alla formazione del trealosio-6-fosfato.
Il trealosio-6-fosfato viene quindi defosforilato a trealosio nella reazione di idrolisi catalizzata dalla trealosio-6-fosfato fosfatasi (EC 3.1.3.12).
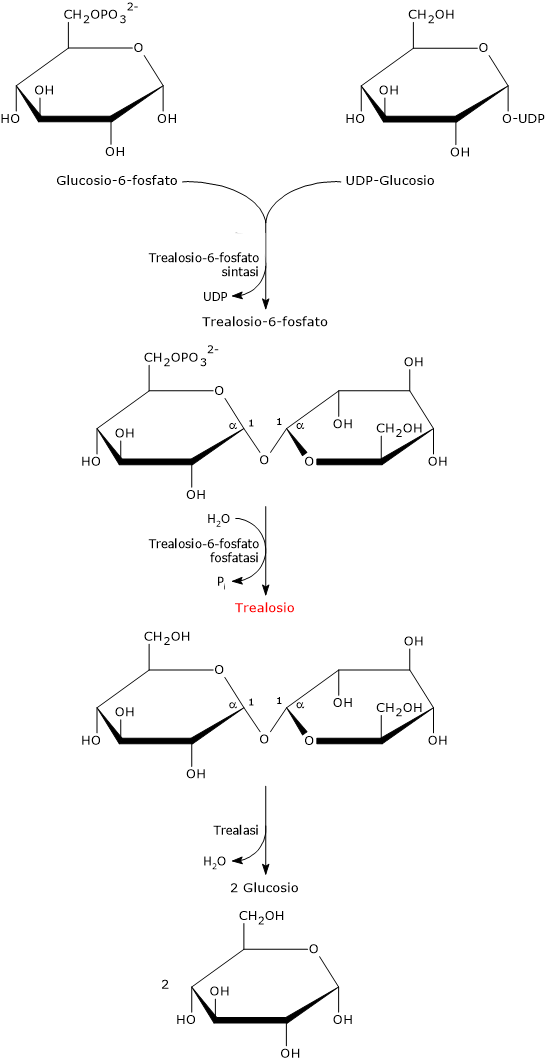
La sua biosintesi è fortemente indotta in seguito all’esposizione a stress abiotici. E l’importanza del trealosio è testimoniata anche dal fatto che alcuni organismi possiedono più di una via metabolica per la sua sintesi.[24]
Nessun gene coinvolto nella sua biosintesi o nel suo deposito è presente nei vertebrati, i quali non sembrano aver perso la capacità di produrlo nel corso del processo evolutivo, bensì sembrano non averla mai acquisita.[2]
Trealosio nelle piante
È il principale disaccaride presente nelle piante in crescita.[18]
Nelle piante fu rilevato per la prima volta nel 1913, in Selaginella lepidophylla, nota come pianta della Resurrezione o falsa rosa di Gerico.[1] In seguito fu trovato anche nelle alghe verdi , nei muschi, nelle felci, e nelle epatiche, piante non-vascolari appartenenti alla divisione Marchantiophyta.[10]
Per molti anni sua presenza nelle angiosperme fu ritenuta conseguenza di contaminazione microbica o batterica, o un artefatto analitico. Le cose cambiarono quando, dagli anni 90 dello scorso secolo, in angiosperme resistenti all’essiccamento, come Myrothamnus flabellifolius and Sporobolus spp, ne furono trovate quantità non giustificabili da contaminazioni microbiche.[9][15] Nonostante ciò, nelle angiosperme il trealosio e il suo metabolismo continuarono a essere considerati di scarso interesse fino a che due osservazioni parallele portarono a un cambio di paradigma.
Nel 1998, in Arabidopsis thaliana, una pianta non tollerante all’essiccamento utilizzata come organismo modello in Botanica, sono stati identificati geni codificanti per forme cataliticamente attive della trealosio-6-fosfato sintasi e della trealosio-6-fosfato fosfatasi.[7][25] Inoltre, sempre nelle angiosperme, l’importanza del metabolismo del trealosio è emersa anche a seguito del tentativo di ingegnerizzarne la produzione con l’introduzione di enzimi di origine fungina o batterica. Come risultato sono state ottenute piante transgeniche con un ampio spettro di anomalie fenotipiche, come ritardo nella senescenza e foglie di forma alterata. Queste osservazioni hanno quindi suggerito che nelle angiosperme:
- la capacità di sintetizzare il trealosio non è limitata alle “piante della resurrezione”;
- una perturbazione del suo metabolismo comporta effetti di larga portata sia sul metabolismo stesso che sullo sviluppo.
Attualmente i geni che codificano per la trealosio-6-fosfato sintasi e la trealosio-6-fosfato fosfatasi sono stati identificati in specie di tutti i principali taxa vegetali, il che suggerisce che il metabolismo del disaccaride è probabilmente universale nel regno vegetale.[13]
Funzioni
Il trealosio svolge molteplici funzioni in organismi molto differenti tra loro. Alcune di queste funzioni sono condivise da organismi differenti, mentre altre sono peculiari di specifici organismi.
- Nelle piante, negli insetti, nei nematodi e nei batteri, è coinvolto nella risposta adattativa a stress abiotici, come temperature estreme, variazioni della pressione osmotica e della salinità, privazione di nutrienti o essicazione.[17] Accumulandosi nella cellula, aiuta l’organismo a superare la condizione stressante limitando i danni alle molecole biologiche.[18] Nelle piante il suo accumulo in condizioni di stress è conseguenza dell’attivazione trascrizionale dei geni che codificano per gli enzimi della sua sintesi o dell’inibizione della trealasi.[12]
Una volta che la situazione stressante si è risolta il trealosio torna a livelli normali.[17] - Può fungere da molecola di deposito di carboidrati e trasporto del carbonio.
In alcune spore batteriche viene accumulato fino a costituire quasi il 25% del peso secco della spora.[19]
Alcuni batteri possono utilizzarlo come fonte esogena di carbonio.[2]
Nei funghi e lieviti viene conservato durante la fase di dormienza.[5]
Negli insetti è il principale zucchero presente nell’emolinfa, dove rappresenta 80-90% dei carboidrati, e costituisce una fonte di energia rapidamente disponibile per il volo.[10][29] - E’ un potenziale metabolita di segnalazione nelle interazioni tra le piante e i microorganismi patogeni e simbionti, nonché con gli insetti erbivori.[18] E alcuni batteri e funghi dipendono dal suo metabolismo per la loro infettività.[17]
Altre funzioni
E’ un componente di lipidi presenti nella parete cellulare di specie batteriche appartenenti ai generi Corynebacterium e Mycobacterium, dove svolge un ruolo strutturale.[11] Ad esempio nella parete cellulare di M. tubercolosis sono presenti glicolipidi contenenti trealosio, come sulfolipidi, e diacil-, triacil- e poliaciltrealosi, dove gli acidi grassi sono legati ai gruppi idrossilici non del glicerolo ma del disaccaride.[24]
Sembra in grado di proteggere gli acidi grassi insaturi con doppi legami cis dal danno ossidativo. E’ stato anche proposto che sia in grado di prevenire l’aggregazione delle proteine interagendo con i doppi legami cis delle catene laterali degli aminoacidi aromatici e limitando l’acetilazione dell’ε-amino gruppo della catena laterale di residui di lisina, acetilazione che aumenterebbe l’idrofobicità delle proteine.[24]
Ha un ruolo cruciale nella crescita e sviluppo degli insetti, rappresentando in certe fasi dello loro sviluppo circa il 20% del totale del pool dei carboidrati.[2]
Il trealosio-6-fosfato è essenziale per lo sviluppo embrionale e vegetativo delle piante, nonché per il metabolismo del saccarosio e dell’amido.[23] E’ stato ipotizzato che la principale funzione del trealosio-6-fosfato sia quella di segnalare e regolare, agendo come un regolatore a feedback negativo, i livelli del saccarosio.[26]
Meccanismi molecolari del potenziale protettivo
Il trealosio interviene nella risposta adattativa a stress abiotici in organismi differenti.[17]
Si ritiene che il suo potenziale protettivo sia dovuto a diversi meccanismi che agiscono in simultanea e sono conseguenza della sue proprietà chimiche, in particolare quella di essere uno zucchero non riducente.[27]
La sua scarsa reattività chimica assicura che non interagisca facilmente con altre molecole presenti nella cellula, come le proteine, il DNA o l’RNA.[8]
La sua elevata idrofilicità gli permette di formare legami idrogeno con l’acqua più forti rispetto a quelli acqua-acqua. E, sebbene anche altri disaccaridi siano in grado di sostituirsi all’acqua, il suo numero di idratazione è maggiore rispetto a quello degli altri disaccaridi. La scarsa reattività chimica e l’elevata idrofilicità lo rendono compatibile con il metabolismo cellulare anche ad alte concentrazioni.[18]
La flessibilità del legame glicosidico α-(1→1), maggiore rispetto alla flessibilità del legame glicosidico di altri disaccaridi, gli permette di conformarsi più facilmente con i gruppi polari presenti sulle altre molecole.[8]
E’ importante anche la grande resistenza del legame glicosidico α-(1→1) all’idrolisi acida e alla scissione a opera delle glucosidasi.[24]
Tuttavia la differenza chiave che distingue il trealosio dagli altri disaccaridi è la sua capacità di formare una sorta di struttura vetrosa attorno alle molecole che risulterebbe stabile anche alle alte temperature e in caso di essiccamento. Ciò che sembra accadere è che il trealosio, sostituendosi alle molecole d’acqua normalmente legate da legami idrogeno con le molecole biologiche, come ad esempio le proteine, le manterrebbe opportunamente ripiegate nella loro struttura nativa.[16]
Digestione del trealosio
Nei mammiferi, la digestione dei carboidrati avviene per la maggior parte nel duodeno. L’alfa-amilasi pancreatica e le idrolasi presenti nell’orletto a spazzola degli enterociti idrolizzano disaccaridi, oligosaccaridi e polisaccaridi nei monosaccaridi costituenti, ovvero glucosio, fruttosio e galattosio. Segue l’assorbimento dei monosaccaridi prodotti.[22]
Il legame glicosidico α-(1→1) del trealosio è idrolizzato nella reazione catalizzata dall’enzima trealasi, reazione che porta al rilascio di due molecole di glucosio.
Deficit della trealasi
Nel genoma umano sono presenti due geni che codificano per isoforme della trealasi.[2] Mutazioni a loro carico portano alla sintesi di enzimi con funzionalità scarsa o assente. In conseguenza di ciò il trealosio non digerito raggiunge la parte distale dell’intestino tenue, dove può causare diarrea osmotica, e, una volta raggiunto il colon, può essere fermentato dai batteri del microbiota intestinale, che è parte del più ampio microbiota umano. Ne risulta la produzione di un eccesso di gas e acidi grassi a catena corta, come l’acido acetico, l’acido propionico e l’acido butirrico, che causano gli altri segni e sintomi della deficienza della idrolasi quali diarrea osmotico-fermentativa, malassorbimento, e altri sintomi addominali.[14]
Poichè non esistono cure per la deficienza della trealasi, l’unico trattamento è evitare o ridurre il consumo di cibi che contengono trealosio.[3]
La deficienza della trealasi è piuttosto rara, sebbene sia più frequente nei nativi della Groenlandia, dove interessa circa l’otto percento della popolazione.
Bibliografia
- ^ Anselmino O. and Gilg E. Uber das Vorkommen von Trehalose in Selaginella lepidophylla. Ber Deut Pharm Ges 1913;23:326-330
- ^ a b c d e Argüelles J.C. Why can’t vertebrates synthesize trehalose? J Mol Evol 2014;79:111-116. doi:10.1007/s00239-014-9645-9
- ^ Arola H., Koivula T., Karvonen A.L., Jokela H., Ahola T., Isokoski M. Low trehalase activity is associated with abdominal symptoms caused by edible mushrooms. Scand J Gastroenterol 1999;34(9):898-903. doi:10.1080/003655299750025372
- ^ Avonce N., Mendoza-Vargas A., Morett E., Iturriaga G. Insights on the evolution of trehalose biosynthesis. BMC Evol Biol 2006;6:109. doi:10.1186/1471-2148-6-109
- ^ Barton J.K., Den Hollander J.A., Hopfield J.J., Shulman R.G. 13C nuclear magnetic resonance study of trehalose mobilization in yeast spores. J Bacteriol 1982;151(1):177-85. doi:10.1128/jb.151.1.177-185.1982
- ^ Berthelot M. Nouvelles recherches sur les corps analogues au sucre de canne. Annales de Chimie et de Physique 1859 3a serie;55:269-282
- ^ Blazquez M., Santos E., Flores C., Martinez-Zapater J., Salinas J., Gancedo C. Isolation and molecular characterization of the Arabidopsis TPS1 gene, encoding trehalose-6-phosphate synthase. Plant J 1998;13(5):685-9. doi:10.1046/j.1365-313x.1998.00063.x
- ^ a b Colaco C., Kampinga J., Roser B. Amorphous stability and trehalose. Science. 1995;268(5212):788. doi:10.1126/science.7754360
- ^ Drennan P.M., Smith M.T., Goldsworthy D., Van Staden J. The occurrence of trehalose in the leaves of the desiccation-tolerant angiosperm Myrothamnus flabellifolius Welw. J Plant Physiol 1993;142(4):493-6. doi:10.1016/S0176-1617(11)81257-5
- ^ a b c d Elbein A.D. The metabolism of alpha,alpha-trehalose. Adv Carbohydr Chem Biochem 1974;30:227-56. doi:10.1016/s0065-2318(08)60266-8
- ^ Elbein A.D., Pan Y.T., Pastuszak I., Carroll D. New insights on trehalose: a multifunctional molecule. Glycobiology 2003;13(4):17R-27R. doi:10.1093/glycob/cwg047
- ^ Fernandez O., Béthencourt L., Quero A., Sangwan R.S., Clément C. Trehalose and plant stress responses: friend or foe? Trends Plant Sci 2010;15(7):409-17. doi:10.1016/j.tplants.2010.04.004
- ^ Figueroa C.M., Lunn J.E. A tale of two sugars: trehalose 6-phosphate and sucrose. Plant Physiol 2016;172(1):7-27. doi:10.1104/pp.16.00417
- ^ Holtug K., Clausen M.R., Hove H., Christiansen J., Mortensen P.B. The colon in carbohydrate malabsorption: short-chain fatty acids, pH, and osmotic diarrhoea. Scand J Gastroenterol 1992;27(7):545-52. doi:10.3109/00365529209000118
- ^ Iturriaga G., Gaff D.F., Zentella R. New desiccation-tolerant plants, including a grass, in the central highlands of Mexico, accumulate trehalose. Australian Journal of Botany 2000;48(2):153-8. doi:10.1071/BT98062
- ^ a b Jain N.K., Roy I. Effect of trehalose on protein structure. Protein Sci 2009;18(1):24-36. doi:10.1002/pro.3
- ^ a b c d e Lee H.J., Yoon Y.S., Lee S.J. Mechanism of neuroprotection by trehalose: controversy surrounding autophagy induction. Cell Death Dis 2018;9(7):712. doi:10.1038/s41419-018-0749-9
- ^ a b c d Lunn J.E., Delorge I., Figueroa C.M., Van Dijck P., Stitt M. Trehalose metabolism in plants. Plant J 2014;79(4):544-67. doi:10.1111/tpj.12509
- ^ McBride M.J., Ensign J.C. Effects of intracellular trehalose content on Streptomyces griseus spores. J Bacteriol 1987;169(11):4995-5001. doi:10.1128/jb.169.11.4995-5001.1987
- ^ a b c d National Center for Biotechnology Information. PubChem Compound Summary for CID 7427, Trehalose. https://pubchem.ncbi.nlm.nih.gov/compound/Trehalose. Accessed Dec. 31, 2023
- ^ Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 6th Edition. W.H. Freeman and Company, 2012
- ^ Rosenthal M.D., Glew R.H. Medical biochemistry: human metabolism in health and disease. A John Wiley & sons, Inc., Publication, 2009
- ^ Schluepmann H., Pellny T., van Dijken A., Smeekens S. and Paul M. Trehalose 6-phosphate is indispensable for carbohydrate utilization and growth in Arabidopsis thaliana. Proc Natl Acad Sci 2003;100(11):6849-6854. doi:10.1073/pnas.1132018100
- ^ a b c d Vanaporn M., Titball R.W. Trehalose and bacterial virulence. Virulence 2020 Dec;11(1):1192-1202. doi:10.1080/21505594.2020.1809326
- ^ Vogel G., Aeschbacher R.A., Muller J., Boller T., Wiemken A. Trehalose-6-phosphate phosphatases from Arabidopsis thaliana: identification by functional complementation of the yeast tps2 mutant. Plant J 1998;13:673-683. doi:10.1046/j.1365-313X.1998.00064.x
- ^ Yadav U.P., Ivakov A., Feil R., Duan G.Y., Walther D., Giavalisco P., Piques M., Carillo P., Hubberten H.M., Stitt M., Lunn J.E. The sucrose-trehalose 6-phosphate (Tre6P) nexus: specificity and mechanisms of sucrose signalling by Tre6P. J Exp Bot 2014;65(4):1051-68. doi:10.1093/jxb/ert457
- ^ a b Yoon Y.S., Cho E.D., Jung Ahn W., Won Lee K., Lee S.J., Lee H.J. Is trehalose an autophagic inducer? Unraveling the roles of non-reducing disaccharides on autophagic flux and alpha-synuclein aggregation. Cell Death Dis 20175;8(10):e3091. doi:10.1038/cddis.2017.501
- ^ Wiggers H.A.L. Untersuchung über das Mutterkorn, Secale cornutum. Annalen der Pharmacie 1832;1(2):129-182. doi:10.1002/jlac.18320010202
- ^ Wyatt G.R., Kale G.F. The chemistry of insect hemolymph. II. Trehalose and other carbohydrates. J Gen Physiol 1957;40(6):833-47. doi:10.1085/jgp.40.6.833