L’acido arachidonico è un acido grasso polinsaturo a 20 atomi di carbonio e 4 doppi legami cis in posizione 5, 8, 11, e 14.[13]
Nell’alimentazione umana le principali fonti sono le uova, la carne e il pesce.[2]
Gli animali sono in grado di sintetizzare l’acido arachidonico a partire dell’acido linoleico, il capostipite della famiglia degli acidi grassi polinsaturi omega-6.[1]
L’acido arachidonico è presente nelle membrane cellulari, esterificato nei fosfolipidi, dove agisce come componente strutturale. Il contenuto più elevato, espresso in percentuale di acidi grassi dei fosfolipidi, si riscontra nelle piastrine.[2][16]
E’ il precursore di numerosi lipidi bioattivi, molecole alla base di molti degli effetti funzionali attribuiti alla molecola. Esempi sono gli eicosanoidi, ossia, leucotrieni, prostaglandine, prostacicline e trombossani, alcuni con attività proinfiammatoria e altri con attività antinfiammatoria.[9]
In soggetti adulti sani, una sua assunzione fino a 1,5 g/die non sembra avere effetti avversi e può concorrere a ridurre il rischio di malattie cardiovascolari.[14]
Indice
- Proprietà chimiche
- Fonti alimentari
- Biosintesi
- Distribuzione cellulare
- Metaboloma dell’acido arachidonico
- Biosintesi dell’acido di Osbond
- Eicosanoidi
- L’acido arachidonico fa male?
- Bibliografia
Proprietà chimiche
L’acido arachidonico ha un peso molecolare di 304,47 g/mol, formula molecolare C20H32O2, e abbreviazione 20:4n-6. Il suo nome secondo la nomenclatura IUAPAC è acido (5Z,8Z,11Z,14Z)-5,8,11,14-eicosatetraenoico, mentre un’abbreviazione ricorrente è ARA.[13]
La sua base coniugata è detta arachidonato ed è la forma con cui, a pH fisiologico, l’acido grasso libero si ritrova nei sistemi biologici, avendo un pKa di 4,82.[10]
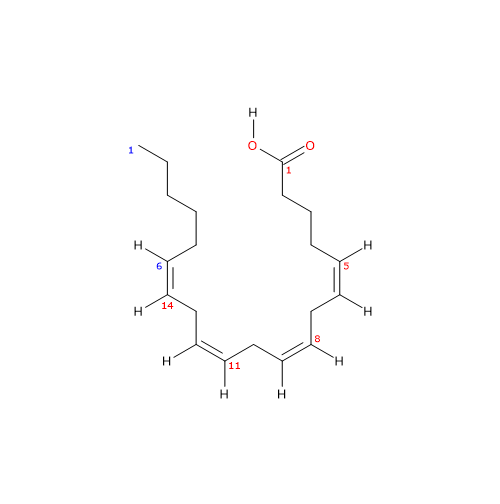
La presenza di 4 doppi legami cis pone l’acido arachidonico nel gruppo degli acidi grassi insaturi. Inoltre, poiché il primo doppio legame, rispetto all’estremità metilica, è in posizione 6, la molecola appartiene al gruppo degli acidi grassi polinsaturi omega-6.[1]
Essendo il numero di atomi di carbonio della catena pari a 20, può essere inserito nel gruppo degli acidi grassi a catena lunga, ossia acidi grassi le cui catene carboniose, sature o insature, sono formate da un numero di atomi di carbonio compreso tra 13 e 21.
E’ praticamente insolubile in acqua (0,00015 g/L).[10]
A temperatura ambiente si presenta come un liquido oleoso con una densità di 0,922 g/ml.[20]
Il suo punto di fusione è pari a -49,5 °C (-57,1 °F; 223,6 K), mentre il punto di ebollizione è pari a 170 °C (338 °F; 443,1 K) a 0,15 mm Hg.[13]
Nelle cellule è presente sia fosfolipidi delle membrane cellulari, in genere esterificato in posizione sn-2, che nei trigliceridi del grasso.[16]
Fonti alimentari
Fonti importanti di acido arachidonico sono le carni, le uova e il pesce.[2]
Nelle carni è presente sia nei tagli magri, dove è concentrato nei fosfolipidi di membrana, che nel grasso visibile. Particolarmente ricco risulta essere il grasso del maiale, circa 1,8 mg/g, mentre tra i tagli magri i più ricchi sono quelli dell’anatra con circa 1 mg/g. Le carni, sia tagli magri che grassi, con le quantità minori sono quelle di manzo e agnello. Tra i pesci si ricordano il tonno e il salmone, con circa 3 mg/g, e le aringhe, con 0,4 mg/g.[12]
L’assunzione media giornaliera in un adulto che segua una dieta occidentale è stata stimata essere compresa tra 50 e 300 mg.[2]
Biosintesi
L’acido arachidonico può essere sintetizzato a partire da precursori endogeni, in particolare dall’acido linoleico, che, con l’acido alfa-linolenico, è uno dei due acidi grassi essenziali per gli animali.[4]
La sua sintesi, che avviene a livello del reticolo endoplasmatico, si compone di cinque reazioni, di cui due di desaturazione e una di allungamento.[1][4]
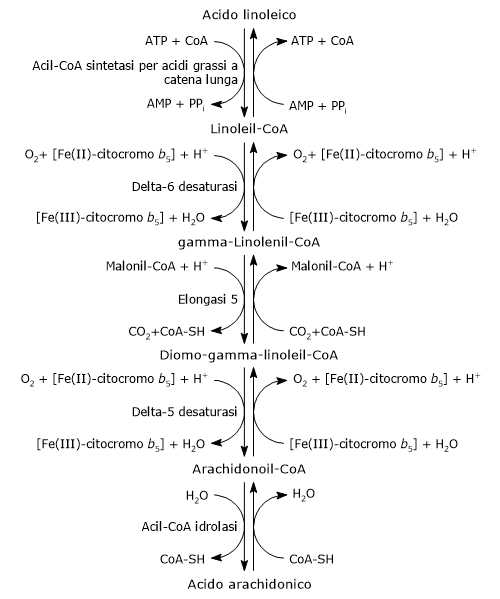
Nella prima reazione l’acido linoleico viene attivato a seguito del legame con il coenzima A o CoA-SH. La reazione è catalizzata da una acil-CoA sintetasi per acidi grassi a catena lunga (EC 6.2.1.3), con spesa di una molecola di ATP.[1]
Il linoleil-CoA è desaturato a dare il gamma-linolenil-CoA. La reazione è catalizzata dalla delta-6 desaturasi (EC 1.14.19.3). L’enzima introduce un doppio legame cis in posizione 6, dall’estremità carbossilica degli acil-CoA.[11] La delta-6 desaturasi è l’enzima limitante dell’intera via e la sua attività è influenzata da deficienze nutrizionali e processi infiammatori.[4][8]
Il gamma-linolenil-CoA viene allungato di due atomi di carbonio, ossia un gruppo acetilico, ceduto dal malonil-CoA, a dare il diomo-gamma-linoleil-CoA. La reazione è catalizzata dalla elongasi 5 (EC 2.3.1.199).[4]
Il diomo-gamma-linoleil-CoA viene desaturato a dare arachidonoil-CoA. La reazione è catalizzata dalla delta-5 desaturasi (EC 1.14.19.44). Al pari della delta-6 desaturasi, l’enzima introduce un doppio legame cis ma in posizione 5 in acil-CoA che presentano un doppio legame in posizione 8 dall’estremità carbossilica.[11]
La delta-5 desaturasi sembra essere potenzialmente limitante in caso di supplementazione con acido gamma-linolenico, tanto che la maggior parte dell’acido diomo-gamma-linolenico prodotto si inserisce in posizione sn-2 dei fosfolipidi, al pari dell’acido arachidonico. La sua attività è influenzata da fattori nutrizionali e ambientali.[16]
Nell’ultima reazione il legame tioestere dell’arachidonoil-CoA viene idrolizzato con liberazione di acido arachidonico. La reazione è catalizzata da una acil-CoA idrolasi (EC 3.1.2.20).[4]
Competizione per le elongasi e desaturasi
Le elongasi e le desaturasi che partecipano alla conversione dell’acido linoleico in acido arachidonico sono anche coinvolte nella sintesi degli acidi acidi grassi polinsaturi omega-3, omega-7 e omega-9. Gli acidi grassi polinsaturi omega-3 sembrano essere i substrati preferiti per le desaturasi; tuttavia, la sintesi degli acidi grassi polinsaturi omega-6 predomina a causa dell’elevato apporto alimentare di acido linoleico.[4]
Ruolo dell’acido linoleico
L’acido linoleico è il principale acido grasso polinsaturo presente nella dieta occidentale.[16]
Basandosi su esperimenti condotti su modelli animali, è stato supposto che anche nell’uomo un aumento dell’assunzione di acido linoleico potesse incrementare la sintesi dell’acido arachidonico. Da ciò sono conseguite raccomandazioni sulla limitazione della sua assunzione per ridurne i livelli tissutali.[23]
Tuttavia è stato dimostrato che non esiste un effetto dose-risposta tra l’assunzione di acido linoleico e i livelli tissutali di acido arachidonico in soggetti che consumino una dieta di tipo occidentale. Questi risultati sono supportati anche dall’osservazione che, negli adulti, il tasso di conversione dell’acido linoleico plasmatico/sierico in acido arachidonico è molto basso, essendo compreso tra lo 0,3% e lo 0,6%.[5] La ragione alla base di ciò non è chiara. Sembra che il fattore limitante non sia la saturazione tissutale di acido arachidonico ma la reazione catalizzata dalla delta-6 desaturasi, poiché ad esempio i livelli di acido arachidonico nei fosfolipidi del sangue aumentano a seguito di somministrazione di acido gamma-linolenico e di acido arachidonico stesso.[16]
Distribuzione cellulare
Le cellule e i tessuti dei mammiferi sono ricchi di acido arachidonico, presente soprattutto nei loro fosfolipidi, in genere esterificato in posizione sn-2.[16]
L’acido arachidonico è uno degli acidi grassi insaturi più importanti presenti nelle membrane cellulari, dove agisce come componente strutturale, in modo simile all’acido eicosapentaenoico (EPA) e all’acido docosaesaenoico (DHA). Aiuta a regolare la fluidità della membrana, la permeabilità selettiva e la flessibilità meccanica.[24]
Negli adulti che seguano una dieta di tipo occidentale il suo contenuto varia a seconda del tipo di cellule. Percentualmente il valore più alto si osserva nelle piastrine, dove costituisce circa il 25% degli acidi grassi dei fosfolipidi. Valori via via decrescenti si ritrovano nelle cellule mononucleate, 22%, nel fegato, 20%, negli eritrociti e nel muscolo scheletrico, 17%, nei neutrofili, 15%, e nel muscolo cardiaco, 9%.[2]
Metaboloma dell’acido arachidonico
L’acido arachidonico può essere convertito in numerosi derivati bioattivi.[9]
L’analisi del metaboloma dell’acido arachidonico evidenzia infatti la presenza di una ampia costellazione di derivati, quali acidi grassi polinsaturi con livelli di insaturazione maggiori e catena carboniosa più lunga, come anche numerosi mediatori lipidici bioattivi, alcuni dotati di attività proinfiammatoria, altri di attività antinfiammatoria o in grado di promuovere la risoluzione degli insulti infiammatori.[9][24]
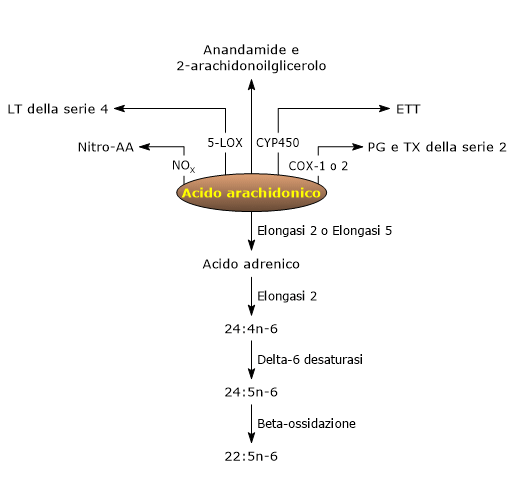
Appartengono al gruppo dei mediatori lipidici bioattivi numerose molecole differenti, quali ad esempio i ligandi per i recettori degli endocannabinoidi, come l’anandamide e il 2-arachidonoilglicerolo, i derivati nitrati dell’acido arachidonico, che sono molecole di segnalazione infiammatoria e vascolare, ma soprattutto gli eicosanoidi.[9]
Biosintesi dell’acido di Osbond
L’acido arachidonico può essere convertito in acido adrenico e di seguito in acido di Osbond (22:5n-6) attraverso quattro reazioni, di cui le prime tre avvengono nel reticolo endoplasmatico, mentre l’ultima nei perossisomi.[1][4]
- Nella prima reazione si verifica il suo allungamento, nella reazione catalizzata dalla elongasi 2 o Elovl2 o dalla elongasi 5 o Elovl5 (per entrambe EC 2.3.1.199), a dare l’acido adrenico (22:4n-6).
- L’acido adrenico è allungato, nella reazione catalizzata dalla elongasi 2, a dare l’acido tetracosatetraenoico (24:4n-6).
- L’acido tetracosatetraenoico è desaturato, nella reazione catalizzata dalla delta-6 desaturasi, a dare l’acido tetracosapentaenoico (24:5n-6).
- Nell’ultimo passaggio, l’acido tetracosapentaenoico è soggetto a beta-ossidazione perossisomiale, a dare l’acido di Osbond o n-6 acido docosapentaenoico (n-6 DPA).
Eicosanoidi
Gli eicosanoidi, ossia prostaglandine, leucotrieni, prostacicline e trombossani, acidi grassi ossigenati a 20 atomi di carbonio, sono potenti mediatori ad azione autocrina e paracrina, di cui il principale precursore è l’acido arachidonico, sebbene possano derivare anche dall’acido diomo-gamma-linolenico, dall’EPA e dal DHA.[1][24]
La loro sintesi, come quella degli altri lipidi bioattivi derivanti dall’acido arachidonico è preceduta dal suo rilascio dai fosfolipidi di membrana in una reazione catalizzata dalla fosfolipasi A2 (EC 3.1.1.4).[6] Una seconda via di rilascio di acido arachidonico, minoritaria, è rappresentata dalla sua liberazione, via idrolisi, dal diacilglicerolo o DAG, in una reazione catalizzata dalla DAG lipasi (EC 3.1.1.-).[21]
Le vie che dall’acido arachidonico portano alla sintesi degli eicosanoidi sono conosciute come “cascata dell’arachidonato”, ed è possibile individuarvi tre vie principali, che prendono il nome dall’enzima che catalizza la prima reazione di ogni percorso metabolico.[4]
Via della ciclossigenasi
Nella via della ciclossigenasi la prima reazione è catalizzata dalla prostaglandina-endoperossido sintasi o ciclossigenasi (E.C. 1.14.99.1).[9]
L’enzima è presente in due forme isoenzimatiche, indicate come ciclossigenasi 1 e 2 o COX-1 e COX-2.[18]
COX-1 è l’isoenzima costitutivo presente nella maggior parte delle cellule, tranne i globuli rossi.
COX-2 è l’isoenzima inducibile. L’enzima è espresso in modo costitutivo e in assenza di infiammazione in tessuti e organi quali l’epitelio gastrico, il cuore, il rene, il sistema vascolare e il cervello, mentre può essere indotto da stimoli infiammatori in cellule quali le cellule epiteliali, i globuli bianchi e le cellule muscolari lisce.[7]
Questa via porta alla sintesi di diverse prostaglandine (PG) della serie 2, e i loro derivati trombossani (TX), anch’essi della serie due, cosiddetti per la presenza nella loro struttura di due doppi legami carbonio-carbonio. Alcune di queste molecole sono dotate di attività proinfiammatoria, come la prostaglandina E2 o PGE2, altre antiinfiammatoria, come il trombossano A2 o TXA2.[17]
Via della lipossigenasi
Nella via della lipossigenasi la prima reazione è catalizzata dalla arachidonato 5-lipossigenasi (5-LOX, EC 1.13.11.34) e porta alla formazione dell’acido 5(S)-idroperossieicosatetraenoico o 5(S)-HPETE.[9]
Attraverso questa via sono sintetizzati leucotrieni (LT) della serie 4, cosiddetti per la presenza nella loro struttura di quattro doppi legami carbonio-carbonio. Sono molecole dotate di attività proinfiammatoria, come il leucotriene B4 o LTB4. Dai leucotrieni della serie 4 possono derivare le lipossine (LX), eicosanoidi con attività antinfiammatorie, come la lipossina A4 o LXA4 e la lipossina B4 o LXB4.[15]
Via della epossigenasi
La citocromo P450 epossigenasi catalizza la prima reazione della via della epossigenasi.[9]
Questa via porta alla formazione di acidi epossieicosatrienoici (EETs), molecole con attività vasorilassante, effetti profibrinolitici come anche effetti antiinfiammatori. In vivo, gli EETs sono rapidamente metabolizzati in acidi diidrossieicosatrienoici o DHETs, in reazioni catalizzate dalla epossi idrolasi solubile. I DHET sono molecole metabolicamente meno attive degli EETs.[22]
Sono raggruppate in questa via metabolica anche altre due serie di reazioni iniziate da altre citocromo P450 ossidasi a funzione mista, cui appartengono enzimi in grado di portare alla formazione di acidi idrossieicosatetraenoici o HETEs, alcuni dei quali sono epimeri dei prodotti formati dalla lipossigenasi, e acidi monoidrossieicosatetraenoici omega-ossidati.[21]
L’acido arachidonico fa male?
L’idea che l’acido arachidonico sia pericoloso deriva dal fatto che:
- diversi tra i suoi derivati sono coinvolti in molte patologie avendo azione proinfiammatoria;
- lo stesso acido arachidonico in forma libera è un potente aggregante piastrinico, un immunosoppressore, e induce risposte infiammatorie;
- gli effetti salutari degli acidi grassi polinsaturi omega-3 frequentemente coinvolgono un “antagonismo” con l’acido arachidonico: spesso infatti lo sostituiscono in parte nei fosfolipidi di membrana e ne inibiscono il metabolismo a eicosanoidi;
- uno studio pubblicato nel 1975, in cui venivano somministrati a volontari sani 6 g/die di ARA, fu interrotto a causa di un aumento drammatico ex vivo dell’aggregazione piastrinica, un evento protrombotico.[19]
Va però sottolineato che spesso gli effetti sopracitati sono stati osservati solo in certi tessuti o cellule e in condizioni non fisiologiche, come lo studio del 1975, per cui tali effetti, come la loro efficacia in condizioni fisiologiche rimangono da definire.[19]
Di contro, in soggetti che assumevano 1,5 g/die di acido arachidonico non sono state evidenziate variazioni nei marker dell’infiammazione, su una serie di funzioni immunitarie, ne sulla reattività piastrinica o il tempo di sanguinamento. Tutto questo indica che una sua assunzione fino a 1,5 g/die in soggetti adulti sani non sembra avere effetti avversi.[14]
Infine va sottolineato che l’acido arachidonico, quando presente in combinazione con DHA nelle formulazioni per i neonati, si associa a una miglior crescita e sviluppo, e nei prematuri all’ottenimento di uno sviluppo immunologico simile a quello dei bimbi allattati al seno, riducendo anche il rischio di enterocolite necrotizzante. Tutto ciò suggerisce un suo ruolo importante nella normale crescita e sviluppo dei neonati.[3]
Bibliografia
- ^ a b c d e f Akoh C.C., Min D.B. Food lipids: chemistry, nutrition, and biotechnology. 3th Edition. 2008. doi:10.1201/9781420046649
- ^ a b c d e Calder P. C. Dietary arachidonic acid: harmful, harmless or helpful? Br J Nutr 2007; 98:451-453. doi:10.1017/S0007114507761779
- ^ Carlson S.E., Montalto M.B., Ponder D.L., Werkman S.H., Korones S.B. Lower incidence of necrotizing enterocolitis in infants fed a preterm formula with egg phospholipids. Pediatr Res 1998;44(4):491-8. doi:10.1203/00006450-199810000-00005
- ^ a b c d e f g Chow C.K. Fatty acids in foods and their health implication. 3th Edition. 2008. doi:10.1201/9781420006902
- ^ Demmelmair H., Iser B., Rauh-Pfeiffer A., Koletzko B. Comparison of bolus versus fractionated oral applications of [13C]-linoleic acid in humans. Eur J Clin Invest 1999;29(7):603-9. doi:10.1046/j.1365-2362.1999.00477.x
- ^ Dennis E.A., Cao J., Hsu Y.H., Magrioti V., Kokotos G. Phospholipase A2 enzymes: physical structure, biological function, disease implication, chemical inhibition, and therapeutic intervention. Chem Rev. 2011;111(10):6130-85. doi:10.1021/cr200085w
- ^ Dubois R.N., Abramson S.B., Crofford L., Gupta R.A., Simon L.S., Van De Putte L.B., Lipsky P.E. Cyclooxygenase in biology and disease. FASEB J. 1998;12(12):1063-73.
- ^ Gregory M.K., Gibson R.A., Cook-Johnson R.J., Cleland L.G., James M.J. Elongase reactions as control points in long-chain polyunsaturated fatty acid synthesis. PLoS One 2011;6(12):e29662. doi:10.1371/journal.pone.0029662
- ^ a b c d e f Harris W.S., Shearer G.C. Omega-6 fatty acids and cardiovascular disease. Friend, not foe? Circulation 2014;130:1562-1564. doi:10.1161/CIRCULATIONAHA.114.012534
- ^ a b HMDB. Metabocard for arachidonic acid. https://hmdb.ca/metabolites/HMDB0001043
- ^ a b Lee J.M., Lee H., Kang S. 3 and Park W.J. Fatty acid desaturases, polyunsaturated fatty acid regulation, and biotechnological advances. Nutrients 2016;8(1):23. doi:10.3390/nu8010023
- ^ Li D., Ng A, Mann N.J., Sinclair A.J. Contribution of meat fat to dietary arachidonic acid. Lipids 1998;33(4):437-440. doi:10.1007/s11745-998-0225-7
- ^ a b c National Center for Biotechnology Information. PubChem Compound Summary for CID 444899, Arachidonic Acid. https://pubchem.ncbi.nlm.nih.gov/compound/Arachidonic-Acid. Accessed Dec. 15, 2024.
- ^ a b Nelson G.J., Schmidt P.C., Bartolini G., Kelley D.S., Phinney S.D., Kyle D., Silbermann S., Schaefer E.J. The effect of dietary arachidonic acid on plasma lipoprotein distributions, apoproteins, blood lipid levels, and tissue fatty acid composition in humans. Lipids 1997;32(4):427-33. doi:10.1007/s11745-997-0056-6
- ^ Powell W.S., Rokach J. Biosynthesis, biological effects, and receptors of hydroxyeicosatetraenoic acids (HETEs) and oxoeicosatetraenoic acids (oxo-ETEs) derived from arachidonic acid. Biochim Biophys Acta 2015;1851(4):340-55. doi:10.1016/j.bbalip.2014.10.008
- ^ a b c d e f Rett B.S. and Whelan J. Increasing dietary linoleic acid does not increase tissue arachidonic acid content in adults consuming Western-type diets: a systematic review. Nutr Metab (Lond) 2011;8:36. doi:10.1186/1743-7075-8-36
- ^ Ricciotti E., FitzGerald G.A. Prostaglandins and inflammation. Arterioscler Thromb Vasc Biol. 2011;31(5):986-1000. doi:10.1161/ATVBAHA.110.207449
- ^ Rouzer C.A., Marnett L.J. Cyclooxygenases: structural and functional insights. J Lipid Res 2009;50 Suppl(Suppl):S29-34. doi:10.1194/jlr.R800042-JLR200
- ^ a b Seyberth H.W., Oelz O., Kennedy T., Sweetman B.J., Danon A., Frolich J.C., Heimberg M. and Oates J.A. Increased arachidonate in lipids after administration to man: effects on prostaglandin biosynthesis. Clin Pharmacol Ther 1975;18:521-529. doi:10.1002/cpt1975185part1521
- ^ Sigma Aldrich. Product information. Arachidonic acid. https://www.sigmaaldrich.com/deepweb/assets/sigmaaldrich/product/documents/199/672/a9673pis.pdf
- ^ a b Sonnweber T., Pizzini A., Nairz M., Weiss G., Tancevski I. Arachidonic Acid Metabolites in Cardiovascular and Metabolic Diseases. Int J Mol Sci 2018;19(11):3285. doi:10.3390/ijms19113285
- ^ Spector A.A. Arachidonic acid cytochrome P450 epoxygenase pathway. J Lipid Res 2009;50 Suppl(Suppl):S52-6. doi:10.1194/jlr.R800038-JLR200
- ^ Wall R., Ross R.P., Fitzgerald G.F., Stanton C. Fatty acids from fish: the anti-inflammatory potential of long-chain omega-3 fatty acids. Nutr Rev 2010;68(5):280-9. doi:10.1111/j.1753-4887.2010.00287.x
- ^ a b c Zhang Y., Liu Y., Sun J., Zhang W., Guo Z., Ma Q. Arachidonic acid metabolism in health and disease. MedComm (2020) 2023;4(5):e363. doi:10.1002/mco2.363