L’acido butirrico o acido butanoico è un acido grasso, dunque un acido carbossilico, che presenta una catena carboniosa lineare formata da quattro atomi di carbonio.
Il suo nome deriva dalla parola greca βούτυρος, che significa burro, da cui è stato per primo isolato.
Si ritrova in piccola quantità nei tessuti animali e vegetali, principalmente come componente dei trigliceridi.
Nei mammiferi deriva per la maggior parte dalla fermentazione anaerobica di fibre e amido resistente ad opera dei batteri del microbiota intestinale, che ne sintetizzano piccole quantità anche dagli aminoacidi.[5][13]
Nell’intestino viene assorbito quasi per intero dai colonociti, per i quali costituisce una importante fonte di energia.[12]
L’acido butirrico svolge anche funzioni regolatorie sia a livello gastrointestinale che periferico, funzioni che si esplicano a seguito del legame a specifici recettori o a seguito del suo utilizzo come substrato in reazioni di acilazione degli istoni.[3][14]
Indice
- Proprietà chimiche
- Fonti alimentari
- Biosintesi
- Assorbimento intestinale
- Trasporto
- Funzione
- Bibliografia
Proprietà chimiche
L’acido butirrico ha un peso molecolare pari a 88,11 g/mol, formula molecolare C4H8O2, formula condensata CH3CH2CH2COOH, e abbreviazione 4:0.[9]
La sua base coniugata è detta butirrato o ione butanoato, ha formula condensata CH3CH2CH2COO–, ed è la forma con cui, a pH fisiologico, l’acido grasso libero si ritrova nei sistemi biologici avendo un pKa pari a 4,81.
L’assenza di doppi legami nella catena carboniosa pone l’acido butirrico nel gruppo degli acidi grassi saturi, e, poiché il numero di atomi di carbonio della catena è inferiore a 6, è uno degli acidi grassi a catena corta o SCFA, insieme all’acido acetico, all’acido propionico, e all’acido valerico, anch’essi con catene carboniose lineari, e all’acido isobutirrico, all’acido isovalerico e all’acido 2-metilbutirrico, che invece presentano catene carboniose ramificate. Si noti che l’acido butirrico e l’acido isobutirrico, che hanno formula molecolare C4H8O2, sono un esempio di isomeria di struttura.
La breve catena carboniosa del butirrato ne influenza le proprietà fisiche. Infatti, proprio le sue piccole dimensioni fanno si che la polarità del gruppo carbossilico vinca, il che rende l’acido grasso solubile in solventi polari come acqua ed etanolo.[12]
A temperatura ambiente si presenta come un liquido oleoso incolore, con un odore sgradevole e penetrante.[9] Al contrario, i suoi esteri a basso peso molecolare, come il metilbutirrato, spesso hanno gusto o aroma piacevole, e per questo sono utilizzati come additivi nell’industria alimentare e dei profumi.[6]
Il suo punto di fusione è pari a -7,9 °C (17,78 °F; 265,25 K), mentre il punto di ebollizione è pari a 163,5 °C.[9]
Fonti alimentari
L’acido butirrico, al pari degli altri acidi grassi, è presente nei tessuti vegetali e animali principalmente come componente dei trigliceridi, sebbene in quantità decisamente inferiori rispetto a quelle degli acidi grassi a catena lunga. Al pari degli altri SCFA, anche il butirrato in genere si trova esterificato in posizione sn-3 dei trigliceridi.
Nell’adulto la principale fonte alimentare è costituita dal latte e prodotti derivati, nei quali è anche il più abbondante tra gli acidi grassi a catena corta presenti.[1] Lo sgradevole odore del burro rancido è dovuto alla sua liberazione, per idrolisi, dai trigliceridi.
Il latte materno costituisce la principale fonte di butirrato per i bambini allattati al seno.[1][12]
Nel corso della digestione dei lipidi, il butirrato presente nei trigliceridi viene liberato principalmente per azione della lipasi linguale. L’enzima, prodotto e secreto dalle ghiandole sierose linguali, porta alla liberazione di un singolo acido grasso, di preferenza appartenente al gruppo degli acidi grassi a catena corta o degli acidi grassi a catena media.
Tuttavia nell’uomo, e nella maggior parte dei mammiferi, la fonte quantitativamente più importante è la fermentazione anaerobica di fibre e amido resistente che avviene nel cieco e nel colon ad opera di specie batteriche del phylum Firmicutes.[13] Giornalmente la produzione ammonta a circa 300-360 mM, su un totale di circa 500-600 mM complessive di SCFA prodotti, con la restante quantità suddivisa tra acido acetico e acido propionico, quindi circa 100-120 mM cadauno,[11][13] corrispondenti a un rapporto molare di circa 60:20:20.
Al pari degli altri acidi grassi a catena corta, la sua concentrazione nel lume intestinale è maggiore nel cieco e nel colon prossimale rispetto alle parti successive dell’intestino, in quanto nel colon distale i substrati per la sua sintesi vanno riducendosi.[7]
Biosintesi
L’acido butirrico può derivare da sintesi esogena, ad opera dei batteri presenti nel cieco e nel colon, ed endogena, in particolare a livello epatico.
Nel corso della digestione dei carboidrati, fibre e amido resistente attraversano non digerite l’intestino tenue, mancando gli enzimi necessari alla loro catabolismo. Nel cieco e nel colon incontrano i batteri del microbiota intestinale i quali, codificando nell’insieme per oltre 260 differenti glicoside idrolasi, sono in grado di idrolizzare i carboidrati non digeribili liberandone i monosaccaridi costituenti, principalmente pentosi, esosi e desossiesosi. I pentosi liberati entrano nella via del pentoso fosfato, gli esosi e i desossiesosi nella glicolisi, in entrambe i casi per portare alla sintesi di piruvato, la base coniugata dell’acido piruvico e principale precursore non solo dell’acido butirrico, ma anche degli altri SCFA prodotti dai batteri intestinali.[8][10]
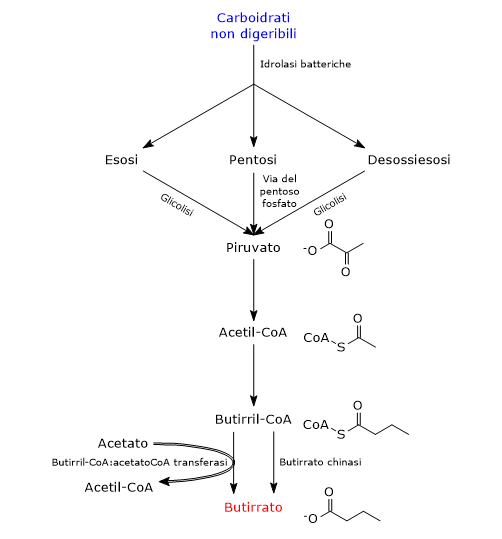 In piccola parte il butirrato può derivare anche dagli aminoacidi.
In piccola parte il butirrato può derivare anche dagli aminoacidi.
La sintesi dell’acido butirrico da parte dei batteri intestinali è influenzata, come quella degli altri SCFA ivi prodotti, da diversi fattori. Derivando dalla fermentazione anerobica di polisaccaridi non digeribili, la quantità di fibre presenti nel lume intestinale, in particolare dell’amido resistente, ne influenza la sintesi. Una dieta ad alto contenuto di fibre, come la dieta mediterranea, può quindi essere un fattore predisponente alla sua sintesi. Importante sarà anche il tempo di transito intestinale.
Essendo l’acido butirrico prodotto principalmente da batteri del phylum Firmicutes, la composizione del microbiota intestinale è in grado di influenzarne la sintesi.[2]
Anche il valore del pH nel lume intestinale è importante in quanto i batteri che producono acido butirrico hanno come valore di pH ottimale 5,5, un valore più acido rispetto a quello in cui predominano i batteri che producono l’acido acetico e l’acido propionico, principalmente specie appartenenti al phylum Bacteroides, pari a circa 6,5.[7]
Sintesi da fibre e amido resistente
Nei batteri, la sintesi dell’acido butirrico può seguire due vie.[11][12]
Nella maggior parte dei batteri produttori di butirrato, l’acido grasso è prodotto attraverso una via metabolica che ha inizio con la condensazione di due molecole di acetil-CoA a dare acetoacetil-CoA, nella reazione catalizzata dalla acetil-CoA acetiltransferasi (EC 2.3.1.9). Di seguito:
- l’acetoacetil-CoA è convertito in beta-idrossibutirril-CoA, nella reazione catalizzata dalla beta-idrossibutirril-CoA deidrogenasi (EC 1.1.1.157);
- il beta-idrossibutirril-CoA è convertito in crotonil-CoA, nella reazione catalizzata dalla crotonasi (EC 4.2.1.17);
- il crotonil-CoA è convertito in butirril-CoA nella reazione catalizzata dalla butirril-CoA deidrogenasi (EC 1.3.1.86);
- infine, il butirril-CoA è convertito in butirrato a mezzo della reazione catalizzata dalla butirril-CoA:acetato CoA transferasi (EC 2.8.3.8), nella quale reazione un acetato esogeno funge da accettore del coenzima A.[4]
In un numero ridotto di specie batteriche produttrici di acido butirrico, il butirril-CoA viene convertito in butirrilfosfato nella reazione catalizzata dalla fosfato butirriltransferasi (EC 2.3.1.19). Nell’ultimo passaggio, catalizzato dalla butirrato chinasi (EC 2.7.2.7), si ha la liberazione di butirrato e formazione di una molecola di ATP.[2]
Sintesi da aminoacidi
Al pari degli altri acidi grassi a catena corta, l’acido butirrico può essere prodotto, in quantità modeste, dagli aminoacidi derivanti dalla degradazione delle proteine. La sintesi avviene nella parte distale del colon, spesso ad opera di batteri non commensali.[5]
Tra gli aminoacidi precursori del butirrato si ritrovano:
- l’acido glutammico, che è uno degli aminoacidi acidi, e gli aminoacidi basici lisina, arginina e istidina, tutti precursori anche dell’acido acetico;
- i due aminoacidi solforati cisteina e metionina, dai quali può derivare, rispettivamente, anche acido acetico e propionico, e acido propionico.[7]
Il metabolismo proteico ad opera dei batteri intestinali, a partire dalla degradazione delle proteine negli aminoacidi costituenti, è influenzato dal pH del lume intestinale, con un pH ottimale neutro o debolmente alcalino, a differenza di quanto accade con la sintesi del butirrato a partire da fibre e amido resistente.[7]
Sintesi endogena
L’acido butirrico può derivare anche da sintesi endogena, principalmente a livello epatico, in due modi. Può essere prodotto attraverso cicli di beta-ossidazione di acidi grassi con catene carboniose più lunghe,[10] o può derivare da sintesi de novo.[14]
Assorbimento intestinale
Circa il 90-95% dell’acido butirrico prodotto dai batteri intestinali viene assorbito dai colonociti nel cieco e nel colon, mentre la restante piccola percentuale è persa con le feci, al pari degli altri acidi grassi a catena corta.[16]
L’ingresso nei colonociti può avvenire per diffusione passiva, o può essere mediato dai trasportatori MCT1, MCT4, SMCT1 e BCRP.[11][14]. I trasportatori sono localizzati sulla superficie apicale della cellula e la loro sintesi può essere regolata da recettori sensibili al butirrato presenti sulla superficie cellulare stessa. La loro presenza è in grado di incrementare fortemente l’ingresso nella cellula dell’acido grasso.
Trasporto
La piccola quantità di acido butirrico non utilizzata dai colonociti lascia la cellula a livello della membrana basolaterale, per trasporto attivo e diffusione passiva, per entrare nella circolazione portale, percorso seguito anche dagli altri due principali acidi grassi a catena corta. Nella circolazione portale il butirrato raggiunge una concentrazione di circa 30 mM/L, analoga a quella raggiunta dal propionato, ma decisamente inferiore a quella dell’acetato, che è di circa 260 mM/L.[7]
Una piccola parte di questi lipidi raggiunge anche il retto, da dove la frazione non utilizzata dai colonociti entra direttamente nella circolazione sistemica a mezzo della vena iliaca interna, in questo modo bypassando il sistema portale, e quindi il fegato.[15]
In circolo, il butirrato, al pari degli altri SCFA, viaggia in forma libera, ossia come acido grasso non esterificato, e, legato alla proteina plasmatica albumina, raggiunge il fegato e gli altri organi. L’ingresso nelle cellule e il trasporto citosolico non richiedono l’intervento di specifiche proteine.[12]
Funzione
Nei colonociti il butirrato è utilizzato sia per scopi energetici che regolatori, questi ultimi derivanti dal legame con recettori proteici specifici o dal suo utilizzo nelle reazioni di acilazione degli istoni.[11][14][15]
L’acido grasso che raggiunge il fegato e, in piccola quantità, pari a circa il 2% della quantità assorbita a livello intestinale, i tessuti periferici, vi svolge funzioni regolatorie.
Funzione energetica
L’acido butirrico è la fonte di energia preferita dai colonociti, dai quali è attivamente metabolizzato a mezzo della beta-ossidazione, ciclo dell’acido citrico e fosforilazione ossidativa. In questo modo l’acido grasso contribuisce, ad esempio, al mantenimento dell’omeostasi cellulare e dell’integrità delle giunzioni strette presenti agli apici cellulari, e quindi anche al mantenimento dell’integrità della barriera intestinale.[5]
Una volta all’interno del mitocondrio, viene convertito in butirril-CoA nella reazione catalizzata da due membri della famiglia delle acil-CoA sintasi specifiche per acidi grassi a catena corta (EC 6.2.1.1), indicati come ACSS1 e ACSS3.[14]
Il butirril-CoA entra quindi nella beta-ossidazione, la cui prima tappa può essere catalizzata da una acil-CoA deidrogenasi specifica per acidi grassi a catena corta (EC 1.3.8.1), ma anche da una acil-CoA deidrogenasi specifica per acidi grassi a catena media (EC 1.3.8.7), essendo questa in grado di utilizzare come substrati acidi grassi con 4-14 atoni di carbonio.[14] Queste deidrogenasi richiedono come coenzima il FAD, mentre l’altra deidrogenasi coinvolta nella beta-ossidazione, la beta-idrossiacil-CoA deidrogenasi (EC 1.1.1.35), ha come coenzima il NAD.
L’acetil-CoA prodotto entra nel ciclo dell’acido citrico a livello della reazione catalizzata dalla citrato sintasi (EC 2.3.3.1), enzima che catalizza la condensazione tra ossalacetato e acetil-CoA a dare citrato. La catena carboniosa dell’acetil-CoA è quindi ossidata a due molecole di anidride carbonica, con contemporanea produzione di un GTP, tre NADH e un FADH2.
Nella tappa successiva del processo di estrazione dell’energia chimica del butirrato si verifica il trasferimento degli elettroni dai coenzimi ridotti, NADH e FADH2, alla catena respiratoria mitocondriale, trasporto elettronico che è accoppiato alla creazione di un gradiente protonico transmembrana.
Infine l’ATP sintasi utilizza l’energia immagazzinata nel gradiente protonico per sintetizzare ATP dall’ADP.
Acilazione degli istoni
Acilazioni e deacilazioni degli istoni sono reazioni che coinvolgono la catena laterale di residui di lisina presenti nella coda N-terminale e svolgono un ruolo di primaria importanza nella regolazione dell’espressione genica delle cellule eucariotiche.
In generale le acilazioni sono catalizzate da aciltransferasi (EC 2.3-), e nel caso delle acetilazioni da specifiche istone acetiltransferasi (EC 2.3.1.48), mentre le deacilazioni sono catalizzate da idrolasi, come le istone deacetilasi (EC 3.5.1.98).
L’acilazione della catena laterale di residui di lisina neutralizza parte delle cariche positive degli istoni, rendendo il nucleosoma meno compatto, aumentando quindi l’accessibilità al DNA e facilitando così l’espressione genica.
L’acido butirrico contribuisce alle acilazioni degli istoni in almeno tre modi.[14]
- La presenza nel citosol di una acil-CoA deidrogenasi specifica per gli SCFA, ACSS2, permette la sintesi di butirril-CoA che, una volta nel nucleo, potrà essere utilizzato come donatore del gruppo acilico. Va inoltre notato che il butirril-CoA di origine citosolica può anche entrare nel mitocondrio, e quello di origine mitocondriale uscirne, a mezzo della carnitina/acil-carnitina translocasi.
- Il butirril-CoA può essere ossidato ad acetil-CoA, contribuendo così alle acetilazioni.
- Infine il butirrato può inibire l’attività delle istone deacetilasi,[7] capacità condivisa con gli altri acidi grassi a catena corta, sebbene le efficienze siano differenti:
fino all’80% per l’acido butirrico;
fino al 60% per l’acido propionico;
l’acido acetico ha la minor capacità inibitoria.
Questa modalità d’azione sulle istone deacetilasi è stata osservata, oltre che nell’intestino e nel tessuto immunitario associato, anche a livello epatico, dove il butirrato, inibendo la istone deacetilasi 2, aumenta l’espressione del recettore per GPL-1, il che potenzia gli effetti di GPL-1 sull’inibizione della sintesi dei lipidi e sull’aumento dell’ossidazione degli acidi grassi.[14][17]
Recettori di membrana
Le funzioni regolatorie dell’acido butirrico, al pari degli altri acidi grassi a catena corta, si esplicano anche a seguito del legame a specifiche proteine di membrana con funzione recettoriale, ossia i recettori accoppiati alle proteine G, tra cui GPR109A, GPR41, GPR43.[3] I vari SCFA hanno differenti capacità di attivare i diversi recettori: GPR109A è più probabile che sia attivato dal butirrato, GPR41 dal butirrato e dal propionato, mentre GPR43 dall’acetato e dal propionato.
Il legame butirrato-recettore determina effetti differenti a seconda del tipo di cellula. A livello gastrointestinale, il butirrato si lega ai recettori presenti sulla superficie apicale delle cellule L, stimolando la produzione di ormoni quali il peptide YY e GLP-1, ormoni che intervengono nella regolazione della sazietà e dell’assunzione di cibo.[13] Il butirrato si lega anche a recettori presenti sulle cellule enterocromaffini, stimolando il rilascio di serotonina, ormone che potrebbe influenzare la motilità intestinale. Nel pancreas, il legame ai recettori presenti sulle cellule beta aumenta il rilascio di insulina.[13].
Tuttavia l’acido butirrico non agisce solo a livello intestinale, ma anche a livello sistemico, essendo ad esempio in grado di influenzare lo sviluppo, la differenziazione e l’attivazione di cellule del sistema immunitario nei tessuti periferici.
Bibliografia
- ^ a b Chow Ching K. Fatty acids in foods and their health implication. 3th Edition. CRC Press, Taylor & Francis Group, 2008
- ^ a b Deleu S., Machiels K., Raes J., Verbeke K., Vermeire S. Short chain fatty acids and its producing organisms: an overlooked therapy for IBD? EBioMedicine 2021;66:103293. doi:10.1016/j.ebiom.2021.103293
- ^ a b Fagundes R.R., Belt S.C., Bakker B.M., Dijkstra G., Harmsen H.J.M., Faber K.N. Beyond butyrate: microbial fiber metabolism supporting colonic epithelial homeostasis. Trends Microbiol 2023:S0966-842X(23)00226-3. doi:10.1016/j.tim.2023.07.014
- ^ KEGG: Kyoto Encyclopedia of Genes and Genomes. Butanoate metabolism. https://www.genome.jp/pathway/map00650+C00136
- ^ a b c Koh A., De Vadder F., Kovatcheva-Datchary P., Bäckhed F. From dietary fiber to host physiology: short-chain fatty acids as key bacterial metabolites. Cell 2016;165(6):1332-1345. doi:10.1016/j.cell.2016.05.041
- ^ Kubitschke J., Lange H., Strutz H. Carboxylic acids, aliphatic. Ullmann’s encyclopedia of industrial chemistry. Wiley-VCH. 2014 doi:10.1002/14356007.a05_235.pub2
- ^ a b c d e f Liu X.F., Shao J.H., Liao Y.T., Wang L.N., Jia Y., Dong P.J., Liu Z.Z., He D.D., Li C., Zhang X. Regulation of short-chain fatty acids in the immune system. Front Immunol 2023;14:1186892. doi:10.3389/fimmu.2023.1186892
- ^ Macfarlane S., Macfarlane G.T. Regulation of short-chain fatty acid production. Proc Nutr Soc 2003;62(1):67-72. doi:10.1079/PNS2002207
- ^ a b c National Center for Biotechnology Information. PubChem Compound Summary for CID 264, Butyric Acid. https://pubchem.ncbi.nlm.nih.gov/compound/Butyric-Acid. Accessed Sept. 24, 2023
- ^ a b Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 6th Edition. W.H. Freeman and Company, 2012.
- ^ a b c d Portincasa P., Bonfrate L., Vacca M., De Angelis M., Farella I., Lanza E., Khalil M.,Wang D.Q.-H., Sperandio M., Di Ciaula A. Gut microbiota and short chain fatty acids: implications in glucose homeostasis. Int J Mol Sci 2022;23:1105. doi:10.3390/ijms23031105
- ^ a b c d e Schönfeld P., Wojtczak L. Short- and medium-chain fatty acids in energy metabolism: the cellular perspective. J Lipid Res 2016;57(6):943-54. doi:10.1194/jlr.R067629
- ^ a b c d e Silva Y.P., Bernardi A., Frozza R.L. The role of short-chain fatty acids from gut microbiota in gut-brain communication. Front Endocrinol (Lausanne) 2020;11:25. doi:10.3389/fendo.2020.00025
- ^ a b c d e f g h Trefely S., Lovell C.D., Snyder N.W., Wellen K.E. Compartmentalised acyl-CoA metabolism and roles in chromatin regulation. Mol Metab 2020;38:100941. doi:10.1016/j.molmet.2020.01.005
- ^ a b van der Beek C.M., Dejong C.H.C., Troost F.J., Masclee A.A.M., Lenaerts K. Role of short-chain fatty acids in colonic inflammation, carcinogenesis, and mucosal protection and healing. Nutr Rev 2017;75(4):286-305. doi:10.1093/nutrit/nuw067
- ^ Xiong R.G., Zhou D.D., Wu S.X., Huang S.Y., Saimaiti A., Yang Z.J., Shang A., Zhao C.N., Gan R.Y., Li H.B. Health benefits and side effects of short-chain fatty acids. Foods 2022;11(18):2863. doi: 10.3390/foods11182863
- ^ Zhao Z.H., Wang Z.X., Zhou D., Han Y., Ma F., Hu Z., Xin F.Z., Liu X.L., Ren T.Y., Zhang F., Xue Y., Cui A., Liu Z., Bai J., Liu Y., Cai G., Su W., Dai X., Shen F., Pan Q., Li Y., Fan J.G. Sodium butyrate supplementation inhibits hepatic steatosis by stimulating liver kinase B1 and insulin-induced gene. Cell Mol Gastroenterol Hepatol 2021;12(3):857-871. doi:10.1016/j.jcmgh.2021.05.006