L’acido caprilico è un acido grasso saturo con una catena alifatica lineare formata da 8 atomi di carbonio.[10]
Le principali fonti nell’alimentazione dell’uomo sono i prodotti caseari e gli oli di cocco e palmisti, dove si ritrova non in forma libera ma come componente dei trigliceridi.[15]
Nel tratto digerente, per azione delle lipasi, l’acido caprilico viene liberato dai trigliceridi, assorbito per diffusione passiva dagli enterociti, e, a mezzo del circolo portale, trasportato al fegato dove è per la maggior parte metabolizzato a fini energetici.[13][14]
Nei mammiferi può essere sintetizzato de novo nella ghiandola mammaria dopo il parto, o prodotto nel fegato a mezzo di cicli di beta-ossidazione di acidi grassi con catene più lunghe.[3][4]
Le applicazioni dell’acido caprilico spaziano dalla farmaceutica all’alimentazione dei bambini prematuri o di soggetti affetti da patologie quali ad esempio la pancreatite acuta.[1][8][9]
Indice
- Proprietà chimiche
- Fonti alimentari
- Assorbimento intestinale
- Trasporto
- Biosintesi
- Acido caprilico e grelina
- Applicazioni
- Bibliografia
Proprietà chimiche
L’acido caprilico ha un peso molecolare di 144,21 g/mol, formula molecolare C8H16O2, formula condensata CH3(CH2)6COOH, e abbreviazione 8:0. Secondo la nomenclatura IUPAC il suo nome è acido ottanoico.[10]
La sua base coniugata è detta ione octanoato o caprilato, ha formula condensata CH3(CH2)6COO–, ed è la forma con cui, a pH fisiologico, l’acido grasso libero si ritrova nei sistemi biologici, avendo un pKa di 4,89.[9]
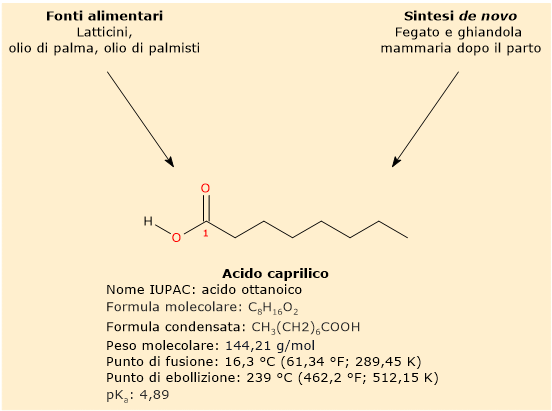 L’assenza di doppi legami nella catena carboniosa pone l’acido caprilico nel gruppo degli acidi grassi saturi. Inoltre, essendo il numero di atomi di carbonio della catena è pari a 8, può esser inserito anche nel gruppo degli acidi grassi a catena media o MCFA, ossia acidi grassi che hanno da 6 a 12 atomi di carbonio nella catena idrocarburica.[1]
L’assenza di doppi legami nella catena carboniosa pone l’acido caprilico nel gruppo degli acidi grassi saturi. Inoltre, essendo il numero di atomi di carbonio della catena è pari a 8, può esser inserito anche nel gruppo degli acidi grassi a catena media o MCFA, ossia acidi grassi che hanno da 6 a 12 atomi di carbonio nella catena idrocarburica.[1]
L’acido caprilico è un isomero dell’acido valproico, un farmaco antiepilettico utilizzato nel trattamento dell’epilessia, del disturbo bipolare e nella prevenzione dell’emicrania.
E’ minimamente solubile in acqua, con un valore pari a 789 mg/L a 30 °C, mentre risulta solubile in etanolo. A temperatura ambiente si presenta come un liquido da incolore a giallo chiaro, con un odore sgradevole che ricorda quello delle capre. Il suo punto di fusione è pari a 16,3 °C (325,4 °F; 436,15 K), mentre il punto di ebollizione è pari a 239 °C (461,2 °F; 512,15 K).[10]
Nei trigliceridi si trova esterificato in prevalenza nelle posizioni sn-1 e sn-3.[7]
Fonti alimentari
Nell’alimentazione umana le principali fonti di acido caprilico sono il latte e derivati, come burro e formaggi, e gli oli di cocco e palmisto.[15]
Nel latte bovino e umano, insieme agli altri MCFA, costituisce circa il 7-17% e il 9-28% degli acidi grassi presenti.[14] Nello specifico, nel latte bovino gli acidi caproico, caprilico e caprico costituiscono il 4-12% del totale degli acidi grassi, con l’acido caprilico al 1,5-3,5%, mentre l’acido laurico il 2,5-4%.[15][16]
Nel corso della stagionatura dei formaggi a pasta dura, piccole quantità di trigliceridi sono idrolizzati con conseguente liberazione di acidi grassi tra i quali gli acidi butirrico, caproico, caprilico e caprico contribuiscono all’aroma caratteristico del prodotto.[3]
Nell’olio di cocco costituisce circa il 5-10% degli acidi grassi presenti, mentre nell’olio di palmisti il 3-5%.[6]
Assorbimento intestinale
A livello del tubo digerente l’acido caprilico presente nei trigliceridi alimentari viene liberato, con gli altri acidi grassi costituenti il lipide, per azione di specifiche lipasi ed è quindi assorbito dagli enterociti.
Il passaggio attraverso la membrana plasmatica dell’enterocita, al pari del passaggio attraverso le altre membrane cellulari con cui verrà in contatto, compresa la membrana mitocondriale interna, avviene per diffusione passiva, quindi in modo indipendente dall’azione di specifiche proteine di trasporto, una modalità condivisa con agli altri MCFA e agli acidi grassi a catena corta o SCFA.[13]
L’elevata velocità con cui sono metabolizzati gli SCFA e i MCFA è probabilmente conseguenza proprio di queste modalità di trasporto, ed è superiore a quella degli acidi grassi a catena lunga che invece necessitano di specifici carrier proteici.[12][13]
Trasporto
La frazione di acido caprilico non utilizzata dall’enterocita lascia la cellula senza essere incorporata nei chilomicroni e passa direttamente nei capillari del circolo portale a mezzo del quale, per la maggior parte legata all’albumina, raggiunge il fegato da cui è assorbito e rapidamente metabolizzato.[14]
Non essendo incorporato nei chilomicroni, quindi bypassando il circolo linfatico e il successivo ingresso nella circolazione sistemica, è improbabile che l’acido grasso sia immagazzinato nel tessuto adiposo.[1][8]
Biosintesi
I mammiferi posseggono il corredo enzimatico per la sintesi sia degli SCFA che dei MCFA, e quindi anche dell’acido caprilico. Gli organi maggiormente interessati sono il fegato e la ghiandola mammaria.
La sintesi epatica avviene principalmente a mezzo di cicli di beta-ossidazione perossisomiale di acidi grassi con catena carboniosa più lunga dell’acido grasso che si vuol sintetizzare. Durante ogni ciclo la catena carboniosa viene accorciata di due atomi di carbonio rispetto all’acido grasso in ingresso.[11] Infine una tioesterasi idrolizza il legame tioestere dell’acil-CoA, il che determina il rilascio dell’acido grasso che può così raggiungere il citosol.[4]
La ghiandola mammaria è in grado di sintetizzare de novo sia l’acido caprilico che gli altri MCFA. La sintesi è innescata dal parto, come dimostrato dall’analisi del secreto ghiandolare prima del parto che mostra la presenza di lipidi ma in quantità molto inferiori rispetto al colostro e al latte.[3] Inoltre, sia negli esseri umani che in altre specie, il tasso di sintesi aumenta con la durata dell’allattamento.[3] Nella ghiandola mammaria la sintesi de novo degli acidi grassi a catena media sembra resa possibile dalla presenza della tioesterasi II (EC 3.1.2.20), una acil-CoA idrolasi in grado di arrestare l’allungamento della catena alifatica prima del raggiungimento dei 16 atomi di carbonio, quindi prima della sintesi dell’acido palmitico, come invece fa la tioesterasi I (EC 3.1.2.2) negli altri tessuti.[5]
Acido caprilico e grelina
L’acido caprilico può fungere da donatore del gruppo acilico nella reazione di acilazione della grelina, ormone oressigenico ossia stimolante l’appetito.
Studi recenti suggeriscono che la riduzione del livello di grelina ottanoilata circolante, ottenibile inibendo l’attività dell’enzima grelina O-aciltransferasi (EC:2.3.1.-) o la disponibilità dell’acido caprilico con l’alimentazione, potrebbe essere una possibile strategia nella lotta all’obesità.[7][8]
Applicazioni
L’acido caprilico ha un’ampia gamma di applicazioni.
Nell’industria farmaceutica viene utilizzato come stabilizzante dell’albumina durante la pastorizzazione, come precipitante selettivo per l’isolamento delle IgG dal siero o dal plasma, e come agente antimicrobico nel trattamento delle infezioni. Tutti questi effetti sono stati associati alla sua capacità di legare proteine e lipidi.[9]
Grazie alle specifiche modalità di trasporto, l’acido caprilico e gli altri MCFA somministrati in forma di oli di trigliceridi a catena media sono particolarmente importanti nell’alimentazione di soggetti affetti da insufficienza pancreatica, malassorbimento dei grassi, alterazione del trasporto dei chilomicroni, e nei bambini prematuri.[1][8]
Nell’ambito della ricerca scientifica, l’acido caprilico sembra avere un potenziale utilizzo come coadiuvante nel trattamento dei tumori gliali di alto grado, le cui cellule, avendo mitocondri difettosi, operano una glicolisi anaerobica anche i presenza di ossigeno e non sono in grado di metabolizzare i corpi chetonici. E’ stato quindi proposto, per il glioblastoma multiforme, un trattamento basato su una chetosi terapeutica. A questo riguardo, l’acido caprilico è tra i migliori precursori di corpi chetonici e, in vitro e ad alte dose, ha indotto necrosi tumorale.[2]
Bibliografia
- ^ a b c d Akoh C.C., Min D.B. Food lipids: chemistry, nutrition, and biotechnology. 3th Edition. 2008. doi:10.1201/9781420046649
- ^ Altinoz M.A., Ozpinar A., Seyfried T.N. Caprylic (octanoic) acid as a potential fatty acid chemotherapeutic for Glioblastoma. Prostaglandins Leukot Essent Fatty Acids 2020;159:102142. doi:10.1016/j.plefa.2020.102142
- ^ a b c d Chow C.K. Fatty acids in foods and their health implication. 3th Edition. 2008. doi:10.1201/9781420006902
- ^ a b Hunt M.C., Siponen M.I., Alexson S.E. The emerging role of acyl-CoA thioesterases and acyltransferases in regulating peroxisomal lipid metabolism. Biochim Biophys Acta 2012;1822(9):1397-410. doi:10.1016/j.bbadis.2012.03.009
- ^ Hunt M.C., Yamada J., Maltais L.J., Wright M.W., Podesta E.J., Alexson S.E. A revised nomenclature for mammalian acyl-CoA thioesterases/hydrolases. J Lipid Res 2005;46(9):2029-32. doi:10.1194/jlr.E500003-JLR200
- ^ Ibrahim N.A., Kuntom A., Tang T.S., Siew W.L. Current status of malaysian crude palm kernel oil characteristics. Oil Palm Bull 2003;47:15–27.
- ^ a b Lemarié F., Beauchamp E., Drouin G., Legrand P., Rioux V. Dietary caprylic acid and ghrelin O-acyltransferase activity to modulate octanoylated ghrelin functions: What is new in this nutritional field? Prostaglandins Leukot Essent Fatty Acids 2018;135:121-127. doi:10.1016/j.plefa.2018.07.009
- ^ a b c d Lemarié F., Beauchamp E., Legrand P., Rioux V. Revisiting the metabolism and physiological functions of caprylic acid (C8:0) with special focus on ghrelin octanoylation. Biochimie 2016;120:40-8. doi:10.1016/j.biochi.2015.08.002
- ^ a b c Li Y. The application of caprylic acid in downstream processing of monoclonal antibodies. Protein Expr Purif 2019;153:92-96. doi:10.1016/j.pep.2018.09.003
- ^ a b c National Center for Biotechnology Information. PubChem Compound Summary for CID 379, Octanoic Acid. https://pubchem.ncbi.nlm.nih.gov/compound/Octanoic-Acid. Accessed Jan. 2, 2025.
- ^ Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 6th Edition. W.H. Freeman and Company, 2012.
- ^ Pégorier J.P., Duée P.H., Herbin C., Laulan P.Y., Bladé C., Peret J., Girard J. Fatty acid metabolism in hepatocytes isolated from rats adapted to high-fat diets containing long- or medium-chain triacylglycerols. Biochem J 1988;249(3):801-6. doi:10.1042/bj2490801
- ^ a b c Roopashree P.G., Shetty S.S., Kumari N.S. Effect of medium chain fatty acid in human health and disease. J Funct Foods 2021;87:104724. doi:10.1016/j.jff.2021.104724
- ^ a b c Schönfeld P., Wojtczak L. Short- and medium-chain fatty acids in energy metabolism: the cellular perspective. J Lipid Res 2016;57(6):943-54. doi:10.1194/jlr.R067629
- ^ a b c Jadhav H.B., Annapure U.S. Triglycerides of medium-chain fatty acids: a concise review. J Food Sci Technol 2023;60(8):2143-2152. doi:10.1007/s13197-022-05499-w
- ^ Jensen R.G. The composition of bovine milk lipids. J Dairy Sci 2002;85:295-350. doi:10.3168/jds.S0022-0302(02)74079-4