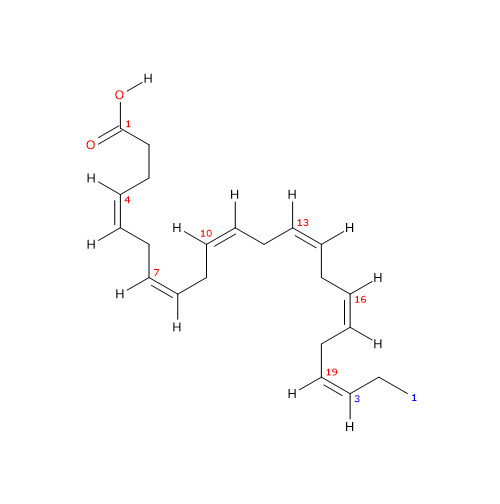
L’acido docosaesaenoico o DHA o acido cervonico o 22:6n-3 è un acido grasso polinsaturo a 22 atomi di carbonio e 6 doppi legami cis in posizione 4,7,10,13,16, e 19. Poiché il primo doppio legame, rispetto all’estremità metilica è in posizione 3, la molecola appartiene alla famiglia degli acidi grassi polinsaturi omega-3 o acidi grassi omega-3, una sottoclasse di lipidi.
Al pari dell’acido arachidonico o ARA, membro della famiglia degli acidi grassi polinsaturi omega-6 o acidi grassi omega-6, e dell’acido eicosapentaenoico o EPA, un altro acido grasso omega-3, è considerato un acido grasso polinsaturo a catena lunga o LC-PUFA.
Tra gli acidi grassi insaturi presenti nel corpo umano in quantità consistente, è quello con la catena carboniosa più lunga e il maggior numero di doppi legami.
Il DHA, come altri due LC-PUFA, è presente principalmente a livello delle membrane cellulari, esterificato nei fosfolipidi, ed è quindi un componente strutturale delle membrane biologiche. E’ particolarmente abbondante nelle cellule nervose, e nel cervello rappresenta l’acido grasso polinsaturo più abbondante.
Molti animali, compreso l’uomo, sono in grado di sintetizzarlo, anche se con efficienza molto variabile, a partire dall’acido alfa-linolenico o ALA o 18:3n-3, il capostipite della famiglia degli acidi grassi polinsaturi omega-3 e, con l’acido linoleico o LA o 18:2n-6, uno dei due acidi grassi essenziali per gli animali. In caso di assenza nella dieta di acido alfa-linolenico, tutti gli altri acidi grassi polinsaturi omega-3, DHA compreso, risultano essenziali, e per questo sono da alcuni definiti semiessenziali.
La sintesi dell’acido docosaesaenoico dall’acido alfa-linolenico procede attraverso reazioni di allungamento e desaturazione, e si svolge tra reticolo endoplasmatico e perossisomi, dove avviene l’ultimo passaggio, ossia una limitata beta-ossidazione. Il pool di desaturasi ed elongasi è in comune alla via di sintesi degli acidi grassi omega-6, omega-7 e omega-9. Esiste dunque una competizione per questi enzimi, competizione che a livello enzimatico favorirebbe gli acidi grassi omega-3 ma, a causa dell’elevato contenuto di acido linoleico nella dieta occidentale, sembra pendere a favore degli acidi grassi polinsaturi omega-6.
L’idea che il DHA potesse apportare benefici alla salute dell’uomo seguì i lavori di Hans Olaf Bang e Jorn Dyerberg i quali, nei primi anni ’70 dello scorso secolo, ricercavano quale fosse la ragione per cui le malattie trombotiche, e in particolare la cardiopatia ischemica, fossero così rare negli eschimesi della Groenlandia. Secondo gli autori, la ragione era da ricercare nella dieta a base di pesce consumata da queste popolazioni, ricca in DHA ed EPA, entrambe rinvenuti in buone quantità nel sangue di questi soggetti.
Queste osservazioni iniziali hanno dato il via a ricerche epidemiologiche, su culture cellulari, come anche a studi di alimentazione condotti sia su animali che sull’uomo, alla ricerca del legame tra i livelli di DHA, e di EPA, e la nostra salute.
Una adeguata assunzione di DHA ed EPA con la dieta è necessaria nel corso di tutto lo sviluppo, a partire dalla vita fetale, e, nel corso della vita adulta, è stata associata a miglioramenti della salute, nonché ad una riduzione del rischio di sviluppare malattie.
Negli ultimi anni si stanno chiarendo i meccanismi molecolari alla base degli effetti funzionali del DHA, meccanismi che chiamano in causa:
- un’azione in forma libera su recettori di membrana accoppiati alle proteine G;
- un’azione, in forma esterificata nei fosfolipidi di membrana, sulla fluidità delle membrane, e sulla composizione delle zattere lipidiche di membrana;
- un ruolo come substrato per la produzione di numerosi mediatori lipidici bioattivi, quali resolvine, maresine e protectine. Questi mediatori lipidici sono coinvolti nella regolazione dell’infiammazione, dell’aggregazione piastrinica, dell’immunità, della contrazione della muscolatura liscia e della funzione renale.
Nell’alimentazione umana le fonti principali sono i prodotti della pesca, in particolare quelli provenienti da acque fredde. Tuttavia, i principali produttori di acido docosaesaenoico, e dell’acido eicosapentaenoico, nella biosfera non sono gli animali ma il fitoplancton: DHA ed EPA, risalendo la catena alimentare, giungono fino alle nostre tavole.
I pesci, molluschi e crostacei che vivono in acque fredde sfruttano l’effetto antigelo di EPA e DHA che, grazie all’elevato grado di insaturazione della catena carboniosa, concorrendo a regolare la fluidità delle membrane cellulari, agiscono come veri e propri antigelo naturali.
Caratteristiche, proprietà chimico-fisiche, nome IUPAC
Peso molecolare: 328,496 g/mol
Formula molecolare: C22H32O2
Punto di fusione: -44 °C (-47 °F; 229 K)
Punto di ebollizione: 446,7 (836,1 °F; 719,8 K)
Nome IUPAC: (4Z,7Z,10Z,13Z,16Z,19Z)-docosa-4,7,10,13,16,19-hexaenoic acid
Numero CAS: 6217-54-5
PubChem: 445580
European Community (EC) Number: 612-950-9
Indice
- Sintesi
- Siti di sintesi
- Distribuzione cellulare
- Meccanismo d’azione: le SPMs
- Bibliografia
Sintesi
Il DHA, al pari dell’acido arachidonico, può essere sintetizzato solo a partire da precursori assunti con la dieta. Di seguito verrà analizzata la via di sintesi dall’acido alfa-linolenico attraverso una serie di sette reazioni. In questa via metabolica si incontreranno tutti gli altri possibili precursori.
Le prime sei reazioni, allungamenti e desaturazioni, si verificano nel reticolo endoplasmatico mentre l’ultima, una beta-ossidazione, nei perossisomi.
- Nella prima reazione ALA è desaturato ad acido stearidonico o 18:4n-3 nella reazione catalizzata dalla delta-6 desaturasi (EC 1.14.19.3), enzima che necessita della presenza di zinco, magnesio e piridossina come cofattori.
- Nella seconda reazione l’acido stearidonico è allungato a 20:4n-3 nella reazione catalizzata dalla elongasi 5 (EC 2.3.1.199, al pari delle altre elongasi, dalla 1 alla 7).
- Il 20:4n-3 è desaturato ad EPA o 20:5n-3 nella reazione catalizzata dalla delta-5 desaturasi (EC 1.14.19.44).
- EPA è allungato ad acido docosapentaenoico o DPA o 22:5n-3 nella reazione catalizzata dalla elongasi 5 e/o dalla elongasi 2. Non è ancora chiaro se una od entrambe le elongasi catalizzino questa reazione.
- Il 22:5n-3 viene allungato a 24:5n-3 nella reazione catalizzata dalla elongasi 2.
- Segue la desaturazione del 24:5n-3 catalizzata dalla delta-6 desaturasi, a 24:6n-3.
- Il 24:6n-3 lascia il reticolo endoplasmatico ed è trasferito nei perossisomi dove subisce la rimozione, attraverso una parziale beta-ossidazione, di un frammento a due atomi di carbonio a dare l’acido docosaesaenoico.
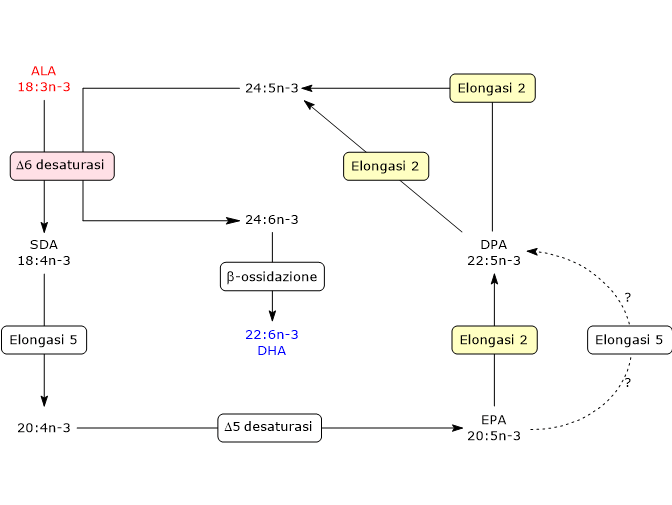
Il DHA lascia i perossisomi e torna nel reticolo endoplasmatico dove viene incorporato nei fosfolipidi di membrana.
Nell’uomo, la percentuale di conversione dell’acido alfa-linolenico in DHA sembra essere molto bassa, oscillando dallo 0% al 4%. Tuttavia valori maggiori, sino al 9%, sono stati ritrovati nelle donne in età fertile, forse per azione degli estrogeni sulla delta-6 desaturasi.
In alcune microalghe marine, come quelle appartenenti ai generi Pavlova e Isochrysis, in un eucariote inferiore marino ed eterotrofo, Thraustochyrium sp., e nel pesce teleosteo marino erbivoro, Siganus canaliculatus, è presente una delta-4 desaturasi che consente di sintetizzare l’acido docosaesaenoico direttamente dal 22:5n3.
Regolazione della sintesi
La sintesi dell’acido docosaesaenoico è influenzata da fattori che modificano l’attività catalitica di alcuni tra gli enzimi coinvolti, in particolare la delta-6 desaturasi e la elongasi 2. Inoltre poiché gli enzimi che catalizzano la produzione di DHA da ALA sono condivisi con le vie che portano alla sintesi degli acidi grassi polinsaturi omega-6, omega-7 e omega-9, i differenti acidi grassi sono in competizione per gli stessi enzimi.
Delta-6 desaturasi
La delta-6 desaturasi catalizza sia l’ossidazione dell’acido alfa-linolenico ad acido stearidonico che del 24:5n-3 in 24:6n-3, il precursore diretto del DHA. La prima reazione rappresenta il passaggio limitante dell’intera via.
L’enzima, al pari della delta-5 desaturasi, è inibito dal colesterolo, dagli acidi grassi saturi, dagli acidi grassi trans, dall’alcol, dai glucocorticoidi, e dall’adrenalina. Anche la carenza di proteine e il digiuno totale riducono l’attività della delta-6 desaturasi, mentre la parziale restrizione calorica e l’insulina la aumentano.
Infine, la competizione tra acido alfa-linolenico e il 24:5n-3 per l’enzima potrebbe spiegare la riduzione nei livelli di DHA osservati a seguito assunzioni di acido alfa-linolenico oltre certi valori.
L’attività di entrambe le desaturasi è ridotta in caso di diabete mellito, iperlipidemia, ipertensione e sindrome metabolica.
Va sottolineato che negli esseri umani le attività della delta-5 desaturasi e della delta-6 desaturasi sono basse, con delta-5 desaturasi > delta-6 desaturasi, per cui la conversione dell’acido alfa-linolenico e dell’acido linoleico nei rispettivi metaboliti potrebbe essere inadeguata alle richieste in determinate condizioni, come la vecchiaia e le malattie.
Elongasi 2
La seconda reazione di allungamento catalizzata dalla elongasi 2, da DPA a 24:5n-3, sembra saturarsi quando l’acido alfa-linolenico, l’acido stearidonico o l’EPA sono forniti con la dieta, il che suggerisce che l’enzima potrebbe avere un ruolo cruciale nel definire se la sintesi di DHA possa essere incrementata attraverso la dieta.
Competizione tra omega-3, omega-6 e omega-9
Gli acidi alfa-linolenico, linoleico e l’acido oleico sono metabolizzati dallo stesso set di desaturasi e di elongasi. Esiste dunque una competizione per questi enzimi. Tuttavia sembra che i substrati preferenzialmente metabolizzati siano gli acidi grassi omega-3, rispetto agli omega-6, e gli acidi grassi omega-6 rispetto agli acidi grassi omega-9, dunque con una sequenza di preferenza omega-3 > omega-6 > omega-9.
Va comunque sottolineato che nella dieta occidentale, come anche nei tessuti, l’acido linoleico è molto più abbondante dell’acido alfa-linolenico, e questo sembra favorire la via che porta alla sintesi degli acidi grassi polinsaturi omega-6 rispetto alle altre, sebbene anche la conversione dell’acido linoleico in acido arachidonico non si estremamente efficiente.
In condizioni fisiologiche, gli acidi grassi polinsaturi omega-9 sono sintetizzati in quantità minime, insignificanti. Questo ha una grande importanza in quanto la presenza in circolo di elevate quantità di acido Mead o 20:3n-9 indica che è in corso una deficienza di acidi grassi essenziali, e quindi di acidi grassi omega-3 e omega-6.
Si noti che entrambe le famiglie omega-3 e omega-6 inibiscono la sintesi degli acidi grassi polinsaturi omega-9.
Siti di sintesi
Il sito principale per la sintesi del DHA è il fegato.
La molecola sintetizzata, a seguito della sua secrezione nel torrente circolatorio, diviene disponibile per l’uptake da parte degli altri organi, quali ad esempio il cervello.
Tra le cellule nervose, ossia neuroni, astrociti, microglia e oligodendrociti, solamente gli astrociti hanno la capacità di sintetizzare l’acido docosaesaenoico, mentre i neuroni, che sono le cellule in cui si verifica il maggior accumulo della molecola, non sono in grado di sintetizzarlo mancando dell’attività desaturasica.
Negli astrociti la capacità di sintesi dell’acido docosaesaenoico è influenzata negativamente dalla disponibilità della molecola preformata. Quindi, nel momento in cui l’apporto dell’acido grasso è adeguato, la loro attività biosintetica è una fonte quantitativamente minore per il suo accumulo nel cervello.
Infine va notato che le cellule dell’endotelio microvascolare cerebrale, sebbene siano in grado di allungare e desaturare gli acidi grassi a catena più corta, fino a 18 C, mancano della capacità di portare a termine l’ultimo passaggio di desaturazione nella sintesi sia del DHA che del 22:5n-6.
Distribuzione cellulare
Nella maggior parte delle membrane cellulari l’acido docosaesaenoico si accumula di preferenza nei due principali fosfolipidi amminici e strutturali ossia fosfatidiletanolammina, e, in misura minore, fosfatidilcolina. Tuttavia questa regola non vale per tutte le cellule. Ad esempio, nelle membrane dei neuroni elevate concentrazioni di DHA sono presenti nella fosfatidilserina, un fosfolipide non strutturale.
All’interno dei fosfolipidi di membrana il DHA, al pari degli altri PUFA, si ritrova esterificato per la maggior parte in posizione sn-2, mentre la posizione sn-1 è occupata in prevalenza da acidi grassi saturi, in particolare l’acido stearico e l’acido palmitico.
Il DHA non è distribuito in modo omogeneo nei diversi tessuti e cellule i quali, sulla base della quantità contenuta, possono essere suddivisi in due categorie.
- Ci sono cellule e tessuti che ne contengono elevate quantità, spesso fino a quasi il 50% delle moli di tutte le catene aciliche. Esempi sono il segmento esterno dei bastoncelli della retina, lo sperma e i neuroni. Queste cellule contengono talmente tanto DHA che nelle loro membrane sono comuni fosfolipidi in cui la molecola è presente non solo in posizione sn-2 ma anche in sn-1. E va notato che in queste sedi i livelli di DHA non sono influenzati dalla dieta.
Il DHA è l’acido grasso polinsaturo più abbondante nel cervello, e numerosi studi sottolineano che tali livelli sono essenziali per una ottimale funzione dei neuroni e della retina. L’aumento del suo contenuto si verifica durante il periodo dello sviluppo, per la maggior parte grazie alla molecola di derivazione dietetica o sintetizzata nel fegato, anche se una certa sintesi può avvenire anche negli astrociti. - Ci sono poi cellule e tessuti che ne contengono normalmente meno di alcune moli percentuali di tutte le catene aciliche. In queste sedi l’acido docosaesaenoico si trova principalmente in posizione sn-2 dei fosfolipidi, non essendo presente in quantità sufficiente da determinare l’esterificazione anche in posizione sn-1.
In queste sedi i livelli di DHA possono essere modificati dalla dieta, per cui è probabile che i benefici per la salute associati all’assunzione della molecola originino da queste sedi.
Meccanismo d’azione: le SPMs
L’acido docosaesaenoico è stato coinvolto praticamente in ogni genere di malattia. Benefici sono stati attribuiti sul cancro, malattie cardiache, funzioni neuronali, problemi immunitari, invecchiamento ma anche altre condizioni quali emicrania, fertilità dello sperma e malaria. Quindi problemi apparentemente non correlati; e proprio questa versatilità suggerisce che l’azione della molecola si svolga ad un livello base, comune a molti tipi cellulari.
Il DHA può apportare benefici alla salute agendo in due modi: come tale o attraverso i suoi metaboliti, di cui al momento ne sono stati descritti oltre 70. E’ stata infatti fornita una prima spiegazione a livello molecolare per i numerosi effetti sulla salute attribuiti a questo acido grasso, come anche ad ARA, EPA e DPA, differente da una sua azione diretta. E’ stata cioè descritta una nuova classe di potenti mediatori lipidici indicata come SPMs, dall’inglese specialized pro-resolving mediators, molecole che sono state coinvolte nella risoluzione attiva dell’infiammazione, nella riduzione del dolore, nella difesa dell’ospite e nella protezione dell’organo dal danno derivante da ischemia-riperfusione.
Le SPMs sono sintetizzate nel sito di infiammazione o di danno tissutale attraverso reazioni catalizzate da enzimi, sono prodotte in piccole quantità, alcune sono collegate ad uno specifico tessuto o tipo cellulare, per altre la sintesi coinvolge più di un tipo cellulare, e si parla pertanto di sintesi trans cellulare.
Sono molecole in grado di regolare in modo potente l’attività delle cellule bersaglio. Ad esempio, nel caso dell’azione sull’infiammazione, a seguito del legame a specifici recettori cellulari, regolano l’infiltrazione dei neutrofili, la produzione di citochine e chemochine e la clearence dei neutrofili apoptotici da parte dei macrofagi, promuovendo in questo modo il ritorno all’omeostasi tissutale.
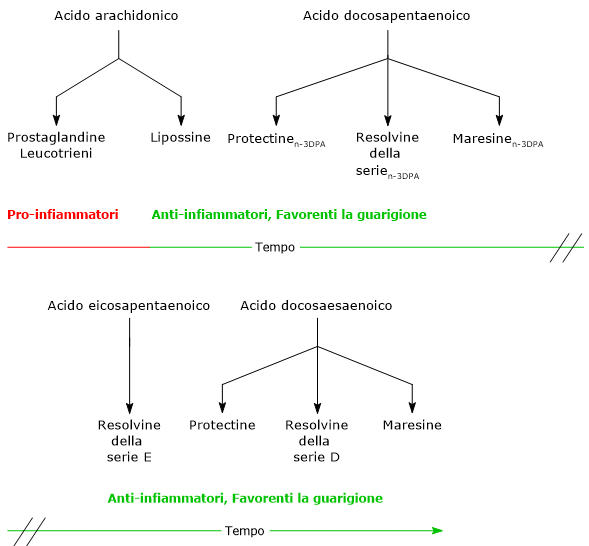
Questa classe di mediatori lipidi comprende quattro famiglie.
- Le Lipossine, le prime SPMs ad essere scoperte, sono sintetizzate dall’acido arachidonico.
- Maresine, Protectine e Resolvine sono sintetizzate a partire da EPA, DPA e acido docosaesaenoico.
Degno di nota è il fatto che mentre ARA è il precursore sia di mediatori lipidici pro-infiammatori che favorenti la risoluzione dell’infiammazione, EPA, DPA e DHA sono precursori di mediatori lipidici con azione anti-infiammatoria e citoprotettiva.
La sintesi di questi mediatori segue un preciso schema temporale. Nell’infiammazione acuta è infatti possibile individuare una fase proinfiammatoria, caratterizzata dalla sintesi di Leucotrieni e Prostaglandine dall’acido arachidonico, e una fase di risoluzione, nella quale sono sintetizzate Lipossine, Maresine, Protectine e Resolvine.
L’acido docosaesaenoico può anche andare incontro ad una perossidazione mediata da radicali liberi a formare metaboliti, quali i Neuroprostani e i Neurochetali, che possono essere prodotti e agire praticamente ovunque e a varie concentrazioni.
Fosfolipasi A2 secretorie
L’acido docosaesaenoico nel sito della lesione può derivare dal torrente circolatorio o essere rilasciato dai fosfolipidi di membrana delle cellule coinvolte.
- La quantità di DHA presente nel sangue intero di soggetti sani è modesta, rappresentando l’1,3-5% del totale degli acidi grassi, variazioni attribuibili alla differenza nell’apporto con l’alimentazione. La molecola circolante raggiunge, entro pochi minuti dal danno iniziale, la sede della lesione, lascia il torrente circolatorio ed è quindi disponibili per la conversione enzimatica in Maresine, Resolvine e Protectine, che andranno ad interagire con le cellule immunitari presenti in loco.
- Il rilascio del DHA dai fosfolipidi di membrana è dovuto all’attività idrolitica delle fosfolipasi A2 secretorie, i primi enzimi ad intervenire nel metabolismo dell’acido docosaesaenoico. Le fosfolipasi A2 secretorie sono una sottofamiglia delle Fosfolipasi A2 (EC 3.1.1.4), una famiglia di idrolasi composta, nei mammiferi, da oltre 30 differenti enzimi, la cui attivazione è conseguenza dello specifico stimolo a carico della cellula bersaglio. Le fosfolipasi A2 secretorie comprendono circa un terzo di tutte le fosfolipasi A2, e catalizzano il rilascio dei PUFA dai fosfolipidi di membrana.
LOX, COX-2, sEH, CYP, GST, GGT e dipeptidasi
Di seguito una breve descrizione dei più importanti enzimi coinvolti nel metabolismo dell’acido docosaesaenoico successivi all’azione delle fosfolipasi A2 secretorie. Questi enzimi, operando uno stretto controllo stereochimico, catalizzano la sintesi di molecole dotate di chiralità. Si noti che la configurazione dei singoli centri chirali viene definita utilizzando il sistema RS o convenzione di Cahn-Ingold-Prelog.
- Lipossigenasi
Catalizzano la formazione di idroperossidi del DHA attraverso l’inserzione di ossigeno in configurazione S. Nello specifico si tratta della 5-lipossogenasi o 5-LOX (EC 1.13.11.34), 12-lipossigenasi o 12-LOX (EC 1.13.11.31) e 15-lipossigenasi o 15-LOX (EC 1.13.11.33).
La 5-lipossigenasi e la 12-lipossigenasi posseggono anche un’attività generante epossidi. - Ciclossigenasi 2
La ciclossigenasi-2 o COX-2 o prostaglandina-endoperossido sintasi 2, assieme alla COX-1, è una delle due isoforme delle ciclossigenasi, enzimi capaci di catalizzare la sintesi di endoperossidi (per entrambe EC 1.14.99.1).
L’attività dei due enzimi è influenzata dall’aspirina che causa l’acetilazione irreversibile di un residuo di serina presente nel sito attivo. L’acetilazione di COX-1 provoca il blocco dell’attività enzimatica, inibendo così la sintesi di Trombossani e Prostaglandine.
Al contrario, l’acetilazione della COX-2 non causa il blocco dell’attività: l’enzima perde l’attività ciclossigenasica, ma acquisisce un’attività simile a quella della 15-lipossigenasi. Infatti l’enzima acetilato, al pari del citocromo P450, catalizza inserzione dell’ossigeno in posizione 17, ma con stereochimica opposta rispetto alle lipossigenasi, ossia R anzichè S. Quindi il prodotto della reazione è il 17R-idroperossi-DHA anziché il 17S-idroperossi-DHA. - Epossido idrolasi solubile
L’enzima, anche indicato come sEH (EC 3.3.2.10), nei mammiferi è in grado di idrolizzare un ampio spettro di epossidi. - Citocromo P450
Diversi componenti della superfamiglia del citocromo P450 intervengono nel metabolismo dell’acido docosaesaenoico. Le isoforme appartenenti alle famiglie 1, 2 e 3 sono prevalentemente epossigenasi, in grado di agire anche su ARA ed EPA, mentre le isoforme appartenenti alla famiglia 4 sono principalmente omega-idrossilasi. - Altri enzimi coinvolti sono alcuni membri della famiglia delle glutatione S-transferasi o GST (EC 2.5.1.18), la gamma-glutamil transferasi o GGT (EC 2.3.2.2), e dipeptidasi.
Maresine
Le Maresine sono una famiglia di molecole con attività analgesica, coinvolte nella risoluzione dell’infiammazione e nella rigenerazione tissutale.
Sono prodotte per lo più nei macrofagi attraverso vie di sintesi differenti che hanno in comune il primo passaggio: l’ossigenazione dell’acido docosaesaenoico in posizione 14, in una reazione catalizzata dalla 12-lipossigenasi. Il prodotto della reazione è l’intermedio idroperossidico 14S-idroperossi-DHA o 14S-HpDHA.
La 12-lipossigenasi dei macrofagi umani converte anche l’acido arachidonico nel corrispondente 14S-idroperossido (98%), con una efficienza equivalente a quella della conversione del DHA in 14S-idroperossi-DHA.
Di seguito due esempi di Maresine.
La Maresina 1 o MaR1 o 7R,14S-diHDHA presenta il triene coniugato E,E,Z.
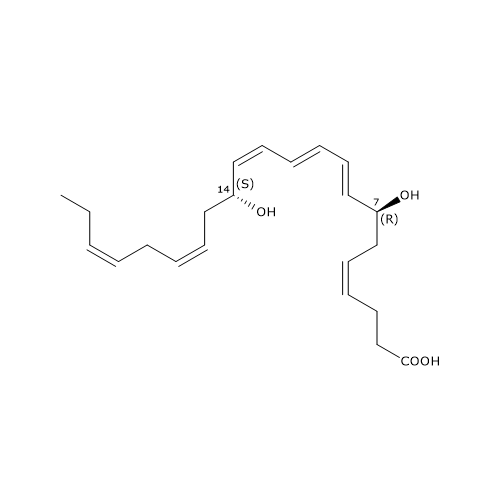
MaR1 è stata il primo membro della famiglia ad essere identificato ed è il prodotto di una via che si compone di tre passaggi, di cui il primo è stato analizzato sopra.
Nel secondo passaggio si verifica l’epossidazione del 14S-idroperossi-DHA, catalizzata dalla 12-lipossigenasi, a dare un 13-14 epossido, la 13S,14S-epossimaresina o 13S,14S-eMaR, o 13S,14S-epossi-DHA, molecola centrale anche nella biosintesi della Maresina 2 e di MCTR1, MCTR3, MCTR3. L’epossido va di seguito incontro ad una idrolisi enzimatica che porta all’introduzione di un gruppo idrossilico in posizione 7 assieme ad un riarrangiamento dei doppi legami con formazione della Maresina 1. La molecola è presente anche negli invertebrati inferiori, come i Platelminti, il che suggerisce che la sua struttura e funzione siano state conservate nel corso dell’evoluzione.
Il 14S-idroperossiDHA può subire una seconda ossigenazione catalizzata dalla 5-lipossigenasi, con formazione del 7S,14S-diidrossi-DHA (E,Z,E), un isomero della Maresina 1.
La Maresina 2 o MaR2 o 13R,14S-diHDHA viene sintetizzata dall’intermedio 13S,14S-epossimaresina in una reazione catalizzata dalla sEH. Al pari della Maresina 1 presenta un triene coniugato, ma con geometria Z,E,E.
MCTR1, MCTR3, MCTR3
Dalla 13S,14S-epossimaresina può anche derivare la famiglia di molecole detta MCTRs, acronimo dell’inglese Maresin conjugates in tissue regeneration.
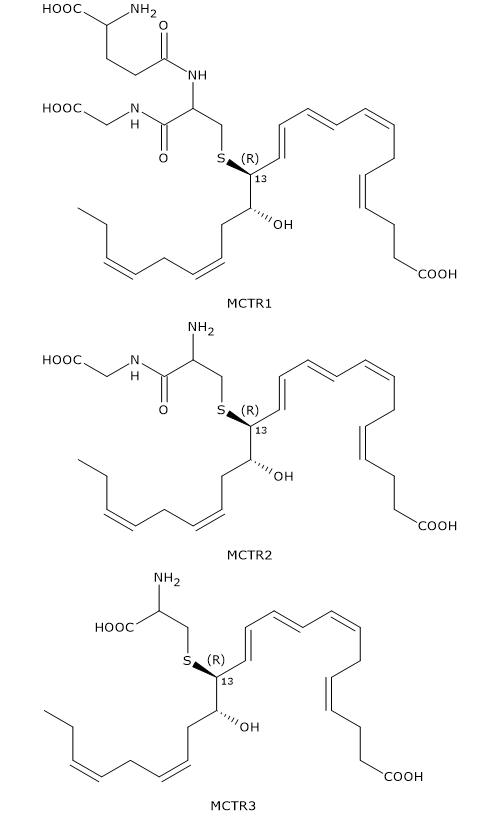
Il primo componente ad essere sintetizzato è MCTR1 o 13R-glutationil,14S-HDHA in una reazione in cui il 13S,14S-eMar reagisce con il glutatione. La reazione può essere catalizzata da due enzimi appartenenti alla famiglia delle glutatione S-transferasi: la leucotriene C4 sintetasi o LTC4S (EC 4.4.1.20) e la GSTM4 (EC 2.5.1.18).
La gamma-glutamil transferasi, il secondo enzima ad intervenire, catalizza la rimozione della porzione gamma-glutammilica di MCTR1 con formazione di MCTR2 o 13R-cisteinilglicinil,14S-HDHA.
Infine, nella reazione catalizzata da una dipeptidasi, viene scisso il legame tra i residui di cisteina e glicina di MCTR2 con formazione del terzo membro della famiglia: MCTR3 o 13R-cisteinil,14S-HDHA.
Le molecole appartenenti a questa famiglia, al pari della Maresina 2, presentano un triene coniugato Z,E,E.
Maresina-L1 e Maresina-L2
Spostandosi dai macrofagi alle piastrine e leucociti, è stata osservata la produzione di derivati dell’acido docosaesaenoico definiti Maresine-L, in particolare la Maresina-L1 o 14S-22-diHDHA, e la Maresina-L2 o 14R,22-diHDHA.
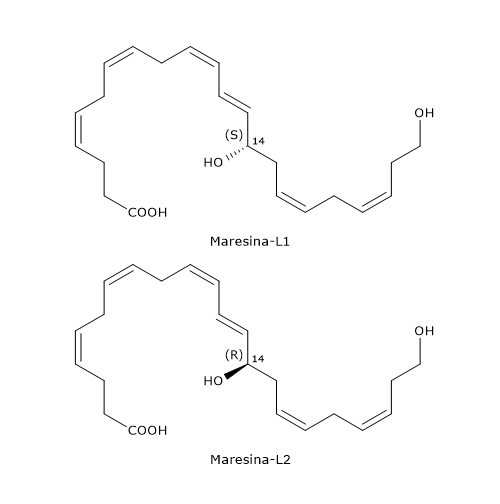
Di seguito sono descritte le vie di sintesi delle due molecole.
- Maresina-L1
L’intermedio 14S-idroperossi-DHA è ridotto a 14S-HDHA, in una reazione catalizzata da una perossidasi.
Nel passaggio successivo il 14S-HDHA subisce una ossidazione in posizione 22 catalizzata da enzimi appartenenti alla famiglia del citocromo P450, con formazione della Maresina-L1. - Maresina-L2
Grazie alle attività del citocromo P450, l’acido docosaesaenoico può anche essere convertito in 14R-HDHA che a sua volta può subire un’idrossilazione in posizione 22, sempre ad opera del citocromo P450, a dare la Maresina-L2.
Dall’azione del citocromo P450 sul 14S-HDHA e 14R-HDHA si vengono a formare anche prodotti ossidati in n-1 quali rispettivamente: 14S,21S-diHDHA, 14S,21R-diHDHA, e 14R,21S-diHDHA e 14R,21R-diHDHA.
L’azione del citocromo P450 sul 14S-HDHA porta anche alla formazione del 14S,20R-diHDHA.
Protectine
Le Protectine sono state scoperte nel tessuto cerebrale nel corso di studi sulla formazione dei metaboliti dell’acido docosaesaenoico in risposta al trattamento con aspirina, da cui l’iniziale nome di Neuroprotectine. In realtà la loro produzione, come la loro azione, non è ristretta al tessuto neuronale, per cui è stato preferito il nome di Protectine.
Sono molecole che, come il DHA, posseggono sei doppi legami. E, al pari dei Leucotrieni e di diverse Maresine, tre di questi doppi legami, quelli in posizione 11, 13 e 15, sono coniugati a dare un triene coniugato. Un’altra caratteristica distintiva è il gruppo idrossilico in posizione 17, presente anche nelle Resolvine della serie D.
La loro struttura è altamente conservata dai pesci sino agli esseri umani.
Il componente più noto della famiglia è la Protectina D1, o PD1, 10R,17S-diHDHA.
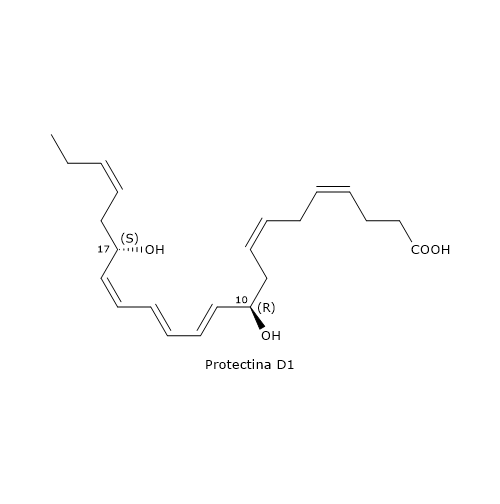
La molecola viene sintetizzata attraverso una via che si compone di tre passaggi.
Nel primo si verifica l’ossigenazione del DHA sulla posizione 17 con formazione del 17S-idroperossi-DHA o 17S-HpDHA. La reazione è catalizzata dalla 15-lipossigenasi ed è condivisa con la via che porta alla sintesi delle Resolvine della serie D.
Nel secondo passaggio, il 17S-HpDHA subisce una epossidazione enzimatica a dare 16S,17S-epossi-DHA.
Nell’ultimo passaggio, l’idrolisi del 16S,17S-epossi-DHA porta alla formazione della PD1. La reazione è catalizzata dalla sEH, enzima che consente l’ottenimento della corretta geometria dei doppi legami del triene coniugato, ossia E,E,Z.
PCTR1, PCTR2, PCTR3
Similmente a quanto visto per le Maresine, e di seguito per le Resolvine della serie D, anche le Protectine possono reagire con il glutatione a dare la famiglia di molecole detta PCTRs, acronimo dell’inglese Protectin conjugates in tissue regeneration.
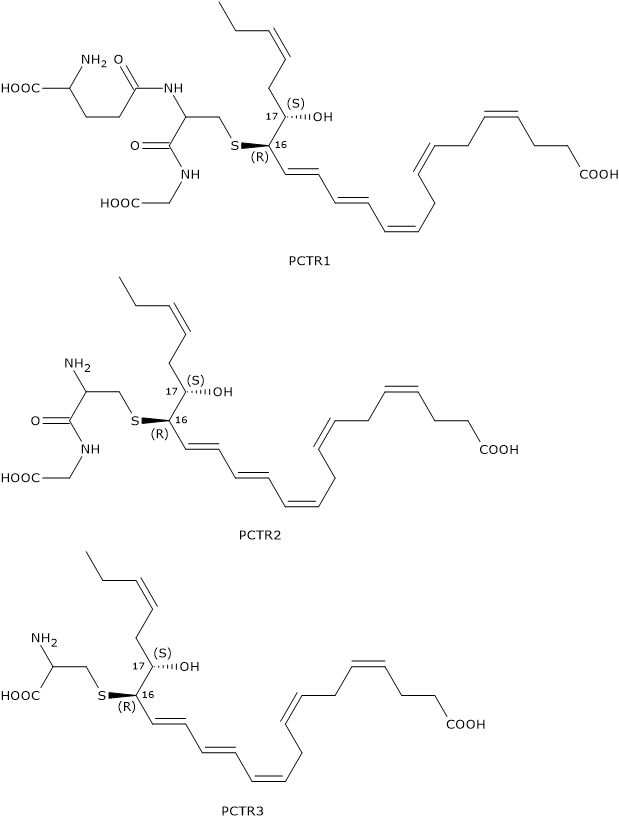
Il primo componente ad essere sintetizzato è PCTR1 o 16R-glutationil-17S-HDHA, in una reazione catalizzata dalla GST, in cui il 16S,17S-epossi-DHA reagisce con il glutatione.
Nel passaggio successivo la gamma-glutamil transferasi catalizza la sintesi di PCTR2 o 16R-cysteinilglicinil,17S-HDHA a seguito della rimozione della porzione gamma-glutammilica di PCTR1.
Nell’ultimo passaggio, catalizzato da una dipeptidasi, il legame tra i residui di cisteina e glicina di PCTR2 è scisso, e questo porta alla formazione di PCTR3.
Protectina X
La Protectina X, anche detta PDX o 10S,17S-diidrossiDHA o 10S,17S-diHDHA, è un isomero di PD1. La differenza tra le due molecole risiede nella:
- configurazione del carbonio 10: R in PD1 e S in PDX;
- geometria del triene coniugato, E,E,Z per PD1 e E,Z,E per PDX.
La via di sintesi di PDX si compone di alcune tappe e ha in comune con la sintesi di PD1 l’intermedio 17S-idroperossi-DHA.
Nel primo passaggio, esclusivo della via di sintesi di PDX, il 17S-idroperossi-DHA va incontro ad una doppia reazione di di-ossigenazione catalizzata dalla 5-lipossigenasi, a dare PDX.
PDX è meno attiva della PD1.
Il 16S,17S-epossi-DHA può andare incontro ad un altro destino, l’idrolisi non enzimatica a dare una miscela racemica di due prodotti minori, il 16R/S,17S-diHDHA e il 10R/S,17S-diHDHA.
Aspirina e Protectine
Una via addizionale per la sintesi delle Protectine è conseguente all’assunzione di aspirina e al suo effetto sull’attività catalitica di COX-2. L’enzima acetilato catalizza l’inserzione dell’ossigeno in posizione 17 dell’acido docosaesaenoico ma con stereochimica R anziché S. Pertanto il DHA viene convertito non in 17S-HpDHA ma in 17R-HpDHA, e tutte le Protectine da esso derivate, definite AT-protectine e sintetizzate secondo le vie metaboliche descritte nei paragrafi precedenti, avranno la stessa stereochimica 17R.
Esempi sono:
- la AT-PD1;
- la miscela racemica composta da 10R/S,17R-diHDHA e 16R/S,17R-diHDHA;
- la 10S,17R-diHDHA.
Quando il substrato della COX-2 è l’acido arachidonico, si viene a produrre il 15R-HETE che è convertito in Lipossine, i mediatori lipidici che per primi danno inizio al processo di risoluzione dell’infiammazione.
Resolvine della serie D
Le Resolvine della serie D sono una famiglia di molecole composta da sei membri, indicati come RvD1-RvD6, o in generale RvDs, dove la lettera D deriva da acido docosaesaenoico, per distinguerle dalle resolvine derivanti da EPA, detta appunto della serie E o RvEs. Sono molecole con una potente attività antiinfiammatoria, neuroprotettiva e favorente la risoluzione dell’infiammazione.
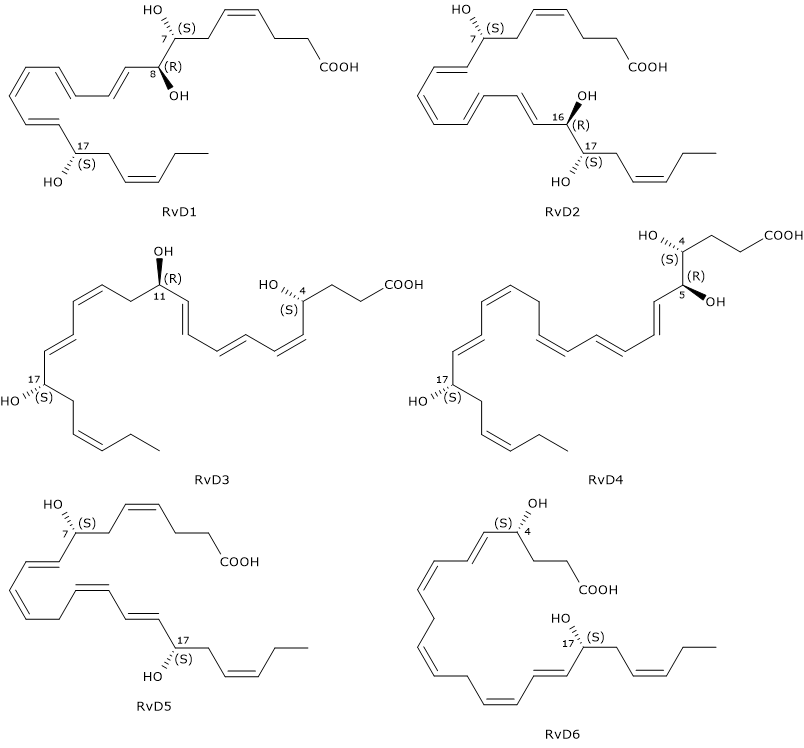
Le Resolvine della serie D hanno sei doppi legami di cui, nelle RvD1 e RvD2, quattro sono coniugati a formare rispettivamente i tetraeni coniugati E,E,Z,E ed E,Z,E,E.
Altra caratteristica distintiva è quella di essere, con l’esclusione di RvD5 e RvD6, molecole triidrossilate. Inoltre, al pari delle
Protectine, presentano un gruppo idrossilico in posizione 17, anche in questo caso introdotto nella reazione catalizzata dalla 15-lipossigenasi. Dunque la via di sintesi delle Resolvine della serie D condivide con quella delle Protectine la prima tappa, la sintesi dell’intermedio 17S-idrossiperossi-DHA.
Di seguito sono analizzati i passaggi che portano alla sintesi dei sei differenti tipi di Resolvine della serie D.
- Il 17S-idroperossi-DHA è ridotto a 17S-idrossi-DHA, in una reazione catalizzata da una perossidasi.
- Il 17S-idrossi-DHA viene convertito rispettivamente in 4S-idroperossi, 17S-idrossi-DHA e 7S-idroperossi, 17S-idrossi-DHA, in una reazione catalizzata dalla 5-lipossigenasi.
- Nel passaggio successivo, i due intermedi vengono convertiti rispettivamente in 4S,5S-, e 7S,8S-epossi, 17S-idrossi-DHA. La sintesi degli epossidi è dovuta alla attività generante epossidi della 5-lipossigenasi.
- L’idrolisi degli epossidi, catalizzata da una idrolasi, porta alla formazione delle Resolvine della serie D dalla 1 alla 4, ossia rispettivamente RvD1 e l’epimero RvD2 dal 7S,8S-epossi-17S-idrossi-DHA, e RvD3 e l’epimero RvD4 dal 4S,5S-epossi, 17S-idrossi-DHA.
- La sintesi della RvD5 e della RvD6 segue vie differenti. La RvD5 deriva dal 7S-idroperossi, 17S-idrossi-DHA a seguito dell’azione di una perossidasi. La RvD6 deriva dal 4S-idroperossi, 17S-idrossi-DHA in modo analogo alla RvD5, ossia per intervento di una perossidasi.
RCTR1, RCTR2, RCTR3
Analogamente a quanto visto per le Maresine e Protectine, anche le Resolvine della serie D possono formare coniugati con il glutatione a dare la famiglia di molecole detta RCTRs, la cui sintesi sembra segua lo schema visto in precedenza per le MCTRs e PCTRs.
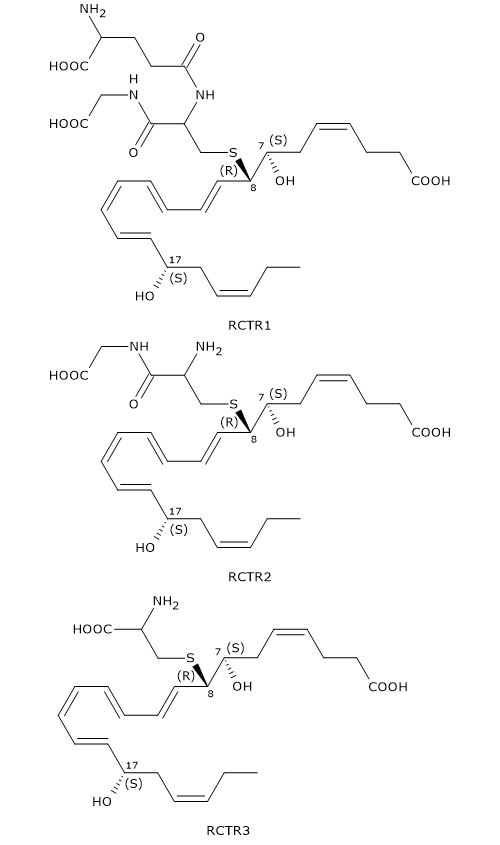
Nello specifico l’intermedio 7S,8S-epossi, 17S-idrossi-DHA reagisce con il glutatione a dare l’RCTR1 o 8R-glutationil-7S,17S-diHDHA. La reazione è catalizzata dalle glutatione S-transferasi.
Nel passaggio successivo la gamma-glutamil transferasi catalizza la conversione di RCTR1 in RCTR2 o 8R-cisteinilglicinil,7S,17S-diHDHA, attraverso la rimozione della porzione gamma-glutammilica di RCTR1
Infine, in una reazione catalizzata da una dipeptidasi, RCTR2 è convertito in RCTR3 o 8R-cisteinil,7S,17S-diHDHA a seguito ella scissione del legame tra i residui di cisteina e glicina di RCTR2.
Aspirina e Resolvine
L’acetilazione della COX-2 innescata dall’aspirina, come nel caso delle Protectine, porta alla sintesi di Resolvine della serie D in cui il gruppo ossidrilico in posizione 17 ha stereochimica R anziché S. Le 17R-Resolvine della serie D sintetizzate sono definite AT-resolvine, e quindi si va dalla AT-RvD1 alla AT-RvD6.
Tali stereoisomeri, come anche nel caso della Maresina-L2, del 20R-diHDHA, del 14R,21S-diHDHA e del 14R,21R-diHDHA possono derivare anche dalla via del citocromo P450.
Recettori per l’acido docosaesaenoico e i suoi derivati
Come detto in precedenza, gli effetti del DHA sulla salute possono essere mediati dai suoi metaboliti come dalla molecola stessa.
L’acido docosaesaenoico è un ligando del recettore nucleare PPARalfa, ma può legarsi anche alla proteina transmembrana GPR120, anche nota come FFAR4.
Dal canto loro i metaboliti dell’acido docosaesaenoico sono molecole che, a seguito del legame a specifici recettori di membrana, hanno un ampio range di azione agendo simultaneamente a differenti livelli e su differenti siti.
Di seguito alcuni esempi di recettori per le Resolvine della seria D.
- ALX/FRP2, con cui interagiscono, tra gli altri, RvD1e AT-RvD1;
- GPR18 o RvD2 receptor (DRV1), cui si lega la RvD2;
- GPR32 o RvD1 receptor (DRV1) cui si legano RvD1, il suo epimero At-RvD1, RvD3 e RvD5.
Bibliografia
- Burdge G.C, Jones A.E, Wootton S.A. Eicosapentaenoic and docosapentaenoic acids are the principal products of α-linolenic acid metabolism in young men. Br J Nutr. 2002;88(4):355-364. doi:10.1079/BJN2002662
- Burdge G.C., Wootton S.A. Conversion of α-linolenic acid to eicosapentaenoic, docosapentaenoic and docosahexaenoic acids in young women. Br J Nutr. 2002;88(4):411-420. doi:10.1079/BJN2002689
- Dalli J., Vlasakov I., Riley I.R., Rodriguez A.R., Spur B.W., Petasis N.A, Chiang N., and Serhan C.N. Maresin conjugates in tissue regeneration biosynthesis enzymes in human macrophages. 2016;113(43):12232-12237. doi:10.1073/pnas.1607003113
- Das U.N. Essential fatty acids: biochemistry, physiology and pathology. Biotechnol J 2006;1;420-439. doi:10.1002/biot.200600012
- Deng B., Wang C.W., Arnardottir H.H., Li Y., Cheng C.Y., Dalli J., Serhan C.N. Maresin biosynthesis and identification of maresin 2, a new anti-inflammatory and proresolving mediator from human macrophages. PLoS One 2014;9(7):e1023629. doi:10.1371/journal.pone.0102362
- Duvall M.G., Levy B.D. DHA- and EPA-derived resolvins, protectins, and maresins in airway inflammation. Eur J Pharmacol 2016;785:144-155. doi:10.1016/j.ejphar.2015.11.001
- Dyerberg J., Bang H.O., Hjorne N. Fatty acid composition of the plasma lipids in Greenland Eskimos. Am J Clin Nutr 1975:28;958-966. doi:10.1093/ajcn/28.9.958
- Giltay E.J., Gooren L.J., Toorians A.W., Katan M.B., Zock P.L. Docosahexaenoic acid concentrations are higher in women than in men because of estrogenic effects. Am J Clin Nutr. 2004;80(5):1167-1174. doi:10.1093/ajcn/80.5.1167
- Gregory M.K., Gibson R.A., Cook-Johnson R.J., Cleland L.G., James M.J. Elongase reactions as control points in long-chain polyunsaturated fatty acid synthesis. PLoS ONE 2011; 6(12):e29662. doi:10.1371/journal.pone.0029662
- Hong S., Lu Y., Tian H., Alapure B.V., Wang Q., Bunnell B.A., Laborde J.M. Maresin-like lipid mediators are produced by leukocytes and platelets and rescue reparative function of diabetes-impaired macrophages. Chem Biol 2014;21:1318-1329. doi:10.1016/j.chembiol.2014.06.010
- Kim H-Y. Novel metabolism of docosahexaenoic acid in neural cells. J Biol Chem 2007;282(26):18661-18665. doi:10.1074/jbc.R700015200
- Kuda O. Bioactive metabolites of docosahexaenoic acid. Biochimie 2017;136:12-20. doi:10.1016/j.biochi.2017.01.002
- Lee J.M., Lee H., Kang S. and Park W.J. Fatty acid desaturases, polyunsaturated fatty acid regulation, and biotechnological advances. Nutrients 2016;8(1):23. doi:10.3390/nu8010023
- Rodriguez A.R., Spur B.W. Total synthesis of pro-resolving and tissue-regenerative Protectin sulfido-conjugates. Tetrahedron Lett 2015;56(42):5811-5815. doi:10.1016/j.tetlet.2015.09.020
- Serhan C.N., Dalli J., Colas R.A., Winkler J.W., Chiang N. Protectins and maresins: new pro-resolving families of mediators in acute inflammation and resolution bioactive metabolome. Biochim Biophys Acta 2015;1851(4):397-413. doi:10.1016/j.bbalip.2014.08.006
- Serhan C.N. and Petasis N.A. Resolvins and protectins in inflammation resolution. Chem Rev 2011;111:5922-5943. doi:10.1021/cr100396c
- Stillwell W. Docosahexaenoic acid: a most unusual fatty acid. Chem Phys Lipids 2008;153(1):1-2. doi:10.1016/j.chemphyslip.2008.02.012
- Weylandt K.-H. Docosapentaenoic acid derived metabolites and mediators – The new world of lipid mediator medicine in a nutshell. Eur J Pharmacol 2016;785:108-115. doi:10.1016/j.ejphar.2015.11.002