L’assorbimento dei lipidi interessa i prodotti della digestione dei trigliceridi, fosfolipidi, esteri del colesterolo e delle vitamine liposolubili ossia acidi grassi liberi, piccole quantità di 2-monogliceridi, lisofosfolipidi, per la maggior parte lisofosfatidilcolina, colesterolo, vitamine liposolubili e glicerolo. Queste molecole, con l’eccezione degli acidi grassi a catena corta, come l’acido acetico, l’acido butirrico e l’acido propionico, e degli acidi grassi a catena media, quindi l’acido caproico, l’acido caprilico, l’acido caprico e l’acido laurico, e del glicerolo, hanno una scarsa solubilità in ambiente acquoso.
Indice
- Le micelle miste
- Assorbimento degli acidi grassi a catena lunga
- Assorbimento dei 2-monogliceridi
- Assorbimento del colesterolo
- Bibliografia
Le micelle miste
Nell’intestino tenue, la superficie luminale degli enterociti è bagnata da uno strato di acqua non mescolato, in inglese unstirred layer. Lo spessore di questo strato d’acqua dipende in modo inverso da quanto il contenuto del piccolo intestino sia stato rimescolato, e rappresenta la principale barriera all’assorbimento dei lipidi meno idrosolubili.
La barriera d’acqua viene superata grazie alla formazione di micelle miste formate dai sali biliari e dai prodotti della digestione dei lipidi stessi. Le micelle “pure” sono costituite da soli sali biliari.
La formazione delle micelle miste ha inizio quando il pH del chimo aumenta e la concentrazione intraluminale dei sali biliari raggiunge o supera la “concentrazione micellare critica”, valore che nel lume intestinale è quasi sempre oltrepassato.
Queste micelle hanno una struttura simile a dischi ritagliati da una membrana a doppio strato, con dimensione variabili da 40 a 600 Å, dunque molto più piccole delle goccioline emulsionate. I sali biliari sono disposti a stabilizzare i bordi di taglio, con la faccia idrofobica a contatto con la parte interna del disco, e la faccia idrofilica che guarda l’ambiente esterno.
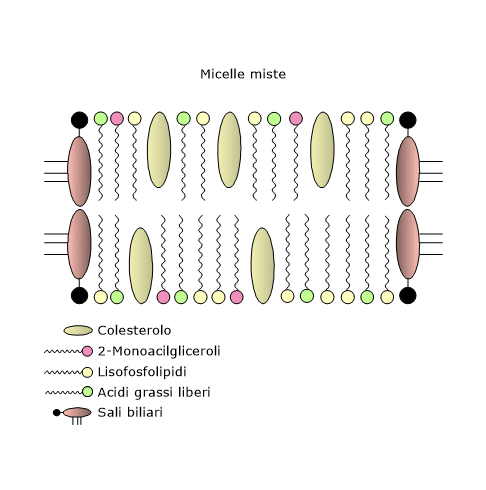
Pertanto questi sali permettono la formazione di strutture solubili in ambiente acquoso, che trasportano i prodotti idrofobici della digestione dei lipidi alla superficie apicale degli enterociti.
Grazie alle micelle miste la concentrazione degli acidi grassi liberi, colesterolo non esterificato, l’unica forma di colesterolo che entra far parte di queste micelle e che può essere assorbita, 2-monoacilgliceroli, lisofosfolipidi e vitamine liposolubili aumenta da 100 a 1000 volte a ridosso degli enterociti, facilitando il loro assorbimento.
Il gradiente di concentrazione dei prodotti della digestione dei lipidi esistente tra la superficie esterna dell’enterocita e il suo interno, lungo il quale fluiscono queste molecole, è mantenuto grazie alla loro rapida riesterificazione a trigliceridi, esteri del colesterolo e fosfolipidi all’interno della cellula.
Lo ione calcio, presente in concentrazioni relativamente alte sia nella succo pancreatico che nella bile, aiuta l’ assorbimento dei lipidi all’interfaccia acqua-lipide.
Infine è interessante notare che, a differenza di quanto accade con i carboidrati, assorbiti solo dopo completa idrolisi nei monosaccaridi glucosio, fruttosio e galattosio, l’assorbimento dei lipidi interessa sia gli acidi grassi liberi e il colesterolo che lipidi parzialmente idrolizzati, come 2-monoacilgliceroli e lisofosfolipidi.
Nota: l’adeguato assorbimento delle vitamine liposolubili dipende dall’adeguato apporto di lipidi con la dieta.
Assorbimento degli acidi grassi a catena lunga
L’assorbimento degli acidi grassi a catena lunga avviene sia per diffusione passiva che per trasporto facilitato mediato da specifici trasportatori proteici.
- La diffusione passiva si verifica grazie a un meccanismo a “flip-flop”, e interessa acidi grassi protonati, dunque privi di carica.
- Il trasferimento mediato da proteine degli acidi grassi a catena lunga potrebbe non essere importante dal punto di vista quantitativo, ma sembra invece esercitare un ruolo regolatorio rispetto il successivo destino metabolico degli acidi grassi assorbiti.
Una volta all’interno dell’enterocita gli acidi grassi sono ivi bloccati attraverso il legame a proteine leganti gli acidi grassi e/o la loro conversione in acil-CoA.
Due proteine coinvolte nell’assorbimento degli acidi grassi oggetto di particolare attenzione sono la Cd36 e la FATP4.
Nota: gli acidi grassi a catena corta e media sono più solubili di quelli a catena lunga. Vengono assorbiti e passano direttamente come tali nel sistema portale dove viaggiano legati all’albumina.
NPC1L1
La proteina appartiene alla famiglia dei facilitatori del trasporto lipidico NPC1, acronimo dell’inglese Niemann-Pick C1 protein, quest’ultima coinvolta nell’uscita del colesterolo dai lisosomi verso il reticolo endoplasmico e la membrana plasmatica.
Sono proteine transmembrana con ben 13 domini che la attraversano; e di questi 5, quelli dal terzo al settimo, formano un dominio sensibile agli steroli o SSD, acronimo dell’inglese sterol sensing domain, che si ritrova anche in altre proteine coinvolte nell’omeostasi del colesterolo, come HMG-CoA reduttasi (EC 1.1.1.34), l’enzima chiave nella sintesi de novo dello steroide, o la 7-deidrocolesterolo reduttasi (EC 1.3.1.21).
La proteina, altamente espressa nel piccolo intestino, dove è localizzata sulla membrana dell’orletto a spazzola degli enterociti, e nel fegato, nelle membrane canalicolari degli epatociti, media l’assorbimento del colesterolo della dieta e il riassorbimento di quello biliare attraverso endocitosi vescicolare. Infine la sua attività sembra essere influenzata anche da glicosilazioni.
La sua localizzazione cellulare è regolata dal colesterolo. Infatti passa dal compartimento endocitico di riciclo, che è parte di un sistema endosomiale coinvolto nel riciclo di molte proteine transmembrana, alla membrana plasmatica in risposta alle variazione nei livelli del colesterolo.
- Quando la concentrazione del colesterolo è bassa si attiva il suo trasporto alla membrana plasmatica.
- Quando invece il colesterolo si è legato al dominio SSD della proteina, localizzata a livello della membrana dell’orletto a spazzola, è probabile che si verifichi una modificazione conformazionale che attiva la sua internalizzazione attraverso endocitosi vescicolare, mediata dal complesso clatrina-AP2, assieme al colesterolo stesso e alla flottilina-1 e flottilina-2, proteine delle zattere lipidiche che formano un complesso con NPC1L1.
NPC1L1 potrebbe dunque rappresentare un ulteriore punto per la regolazione dell’omeostasi del colesterolo, in aggiunta all’inibizione a feedback della HMG-CoA reduttasi e del recettore per le LDL.
>Una volta che NCP1L1 e gli steroli legati, comprendenti oltre al colesterolo anche steroli di origine vegetali come sitosterolo, campesterolo e sitostanolo, o il brassicasterolo, il principale sterolo dei crostacei, sono trasportati al reticolo endoplasmico, sono esterificati dalla colesterolo acil-CoA acil transferasi 2 o ACAT2 (EC 2.3.1.26).
Il triplo complesso MyoVb•Rab11a•Rab11-FIP2
Il trasporto di NPC1L1 alla membrana plasmatica dipende dai microfilamenti di actina e dal triplo complesso MyoVb•Rab11a•Rab11-FIP2, quest’ultimo essenziale per il trasporto vescicolare endocitico e il riciclo di numerose altre proteine, e non solo nell’enterocita, come GLUT4, CFTR, i recettori beta2 adrenergici e i recettori per la transferrina.
Chi sono i componenti del triplice complesso?
- MyoVb è una proteina che fa parte della famiglia delle miosine, motori proteici responsabili della mobilità basata sui filamenti di actina. Le miosine Va, Vb, e Vc sono coinvolte in una ampia gamma di eventi di trasporto vescicolare in diversi tessuti dei mammiferi.
- Rab11a appartiene alla famiglia delle piccole GTPasi (EC 3.6.5.2), e recluta MyoVb alle loro vescicole bersaglio.
- Rab11-FIP2 fa da ponte tra MyoVb e le proteine delle vescicole di riciclo endocitico.
Come funziona il triplo complesso?
Allo stato stazionario Rab11a e Rab11-FIP2 , tutte localizzate sulle membrane del sistema endocitico di riciclo, e mediano l’interazione di NCP1L1 e MyoVb. Quando i livelli cellulari di colesterolo scendono Rab11a si dissocia dal complesso NPC1L1-MyoVb, il che permette l’esportazione del complesso verso la membrana plasmatica in un modo microfilamenti-dipendente.
Nel contempo, un’altra proteina, Cdc42 si attiva e si associa al complesso NPC1L1-MyoVb. Quindi, si attiva la vescicolazione, e questo permette l’esportazione del complesso dal sistema di riciclo endocitico e la sua migrazione verso la membrana plasmatica.
Una volta arrivati sulla membrana plasmatica, MyoVb e l’actina si dissociano da NPC1L1.
name=”Cdc42″>Cdc42
La proteina è un membro della famiglia Rho di piccole GTPasi e sembra essere essenziale nella regolazione della movimentazione intracellulare di NPC1L1 a seguito di variazioni intracellulare della concentrazione del colesterolo. Inoltre, a questa proteina sono state ascritte numerose funzioni sia riguardo al traffico di membrana che la polarità cellulare.
La proteina passa da uno stato inattivo che lega il GDP a uno attivo che invece lega il GTP a seguito della deplezione del colesterolo. Il passaggio da uno stato all’altro è regolato da diversi fattori quali:
- i fattori di scambio dei nucleotidi guaninici o GEFs;
- gli inibitori della dissociazione dei nucleotidi guaninici o GDIs;
- le proteine attivanti le GTPasi o GAPs.
Poiché l’attivazione di Cdc42 è mediata da specifiche GEFs, la deplezione del colesterolo sembra potrebbe cambiare i componenti strutturali della membrana causando riarrangiamenti spaziali delle proteine associate alla membrana stessa, che a loro volta porterebbero a contatto Cdc42 e GEFs, determinando così l’attivazione di Cdc42.
>Una volta che Cdc42 ha legato il GTP interagisce con N-WASP attivandola; a sua volta N-WASP si lega e attiva il complesso Arp2/3 che inizia la polimerizzazione ramificata dei microfilamenti di actina, che è essenziale per la formazione e il trasporto delle vescicole.
In che modo Cdc42 gioca un ruolo essenziale nell’assorbimento dei lipidi?
La deplezione del colesterolo attiva Cdc42, e il legame di Cdc42-GTP a NPC1L1 promuove la dissociazione da Rab11a e l’associazione a MyoVb e actina.
>Cdc42-GTP può attivare anche il complesso N-WASP-Arp2/3 che regola la polimerizzazione dell’actina vicino alle vescicole dove si trova NPC1L1, che a sua volta può guidare la gemmazione, la scissione e il movimento delle vescicole stesse.
Quindi gli eventi legati al traffico vescicolare sono dipendenti dal citoscheletro e da motori proteici.
Influenze sull’assorbimento del colesterolo
Come visto, per l’assorbimento del colesterolo sono fondamentali le micelle miste. Ma non tutto il colesterolo presente nel lume del piccolo intestino viene assorbito, anzi, poco meno del 50% è perso nelle feci, percentuali influenzate da diversi fattori quali le fibre, il tempo di transito intestinale, la quantità totale di colesterolo presente a livello intestinale, nonché i lipidi più polari.
- Un elevato apporto di fibre riduce l’assorbimento del colesterolo attraverso almeno due fattori. Fibre quali lignine e cellulosa ne riducono la disponibilità sia agendo come adsorbenti che riducendo il tempo di permanenza del cibo nel piccolo intestino, e quindi il tempo a disposizione per il suo assorbimento.
>Gomme e pectine lavorano in modo differente agendo non come adsorbenti, ma dando al chimo una consistenza gelatinosa in conseguenza della quale il colesterolo presente è meno disponibile per l’assorbimento. Anche queste fibre riducono il tempo di transito intestinale. - L’assorbimento dei lipidi più polari, necessari assieme ai sali biliari per la solubilizzazione del colesterolo, ne può causare la precipitazione, rendendo così la molecola indisponibile per l’assorbimento.
- Infine, maggiore è la quantità di colesterolo presente e minore sarà la quantità assorbita, e viceversa.
Da notare che la velocità di assorbimento del colesterolo è molto bassa se confrontata a quella degli acilgliceroli e degli acidi grassi.
Bibliografia
- Abumrad N.A. and Davidson N.O. Role of the gut in lipid homeostasis. Physiol Rev 2012:92(3);1061-1085. doi:10.1152/physrev.00019.2011
- Berdanier C.D., Dwyer J., Feldman E.B. Handbook of nutrition and food. 2th Edition. CRC Press. Taylor & Francis Group, 2007
- Chu B-B., Ge L., Xie C., Zhao Y., Miao H-H., Wang CJ., Li B-L., and Song B-L. Requirement of Myosin Vb·Rab11a·Rab11-FIP2 complex in cholesterol-regulated translocation of NPC1L1 to the cell surface. J Biol Chem 2009:284(33);22481-22490. doi:10.1074/jbc.M109.034355
- Rosenthal M.D., Glew R.H. Medical biochemistry – Human metabolism in health and disease. John Wiley J. & Sons, Inc., Publication, 2009
- Skov M., Tonnesen C.K., Hansen G.H., Danielsen E.M. Dietary cholesterol induces trafficking of intestinal Niemann-Pick Type C1 Like 1 from the brush border to endosomes. Am J Physiol Gastrointest Liver Physiol 2011:300(1);G33–G40. doi:10.1152/ajpgi.00344.2010
- Stipanuk M.H., Caudill M.A. Biochemical, physiological, and molecular aspects of human nutrition. 3rd Edition. Elsevier health sciences, 2012
- Storch J., Zhou Y.X., Lagakos W.S. Metabolism of apical versus basolateral sn-2-monoacylglycerol and fatty acids in rodent small intestine. J Lipid Res 2008;49(8):1762-1769. doi:10.1194/jlr.M800116-JLR200
- Xie C., Li N., Chen Z.J., Li B.L., Song B.L. The small GTPase Cdc42 interacts with Niemann-Pick C1-like 1 (NPC1L1) and controls its movement from endocytic recycling compartment to plasma membrane in a cholesterol-dependent manner. J Biol Chem 2011;286:35933-35942. doi:10.1074/jbc.M111.270199