La digestione dei lipidi e l’assorbimento dei lipidi liberati sono processi complessi che coinvolgono enzimi solubili in ambiente acquoso e substrati insolubili, neutri e anfipatici, e si svolgono soprattutto nello stomaco e nel piccolo intestino.
I lipidi presenti nella dieta dell’uomo sono i trigliceridi, i fosfolipidi, gli steroidi, in particolare il colesterolo e i suoi esteri, le vitamine liposolubili, ossia le vitamina A, D, E e K, e i carotenoidi.
Possono essere presenti in forma di grassi, solidi a temperatura ambiente, e oli, liquidi.
- I trigliceridi o triacilgliceroli rappresentano circa il 90% di tutti i lipidi ingeriti. Sono formati da una unità di glicerolo esterificata a tre acidi grassi, per la maggior parte a catena lunga, 16-20 atomi di carbonio. Hanno una densità energetica più che doppia rispetto ai carboidrati, circa 9 kcal/g contro circa 3,75 dei carboidrati, e agli aminoacidi, ma per poter essere utilizzati come composti energetici devono liberare i loro acidi grassi.
- I fosfolipidi, i principali costituenti delle membrane biologiche, sono formati da una molecola di glicerolo esterificata a due acidi grassi in posizione sn-1 e sn-2, e a un acido ortofosforico in posizione sn-3. A sua volta il gruppo fosfato lega tramite legame estere un gruppo idrofilico, ad esempio colina, serina, o inositolo.
- L’assunzione giornaliera di fosfolipidi con la dieta è modesta, 1-2 g; tuttavia nel piccolo intestino si vengono a ritrovare anche i fosfolipidi presenti nella bile, che ne trasporta 10-20 g al giorno, principalmente fosfatidilcolina.
- Il colesterolo e i suoi esteri, insieme a piccolissime quantità di ormoni steroidei, sono solo di origine animale, a differenza dei lipidi visti sinora che possono avere provenienza anche vegetale. Nel piccolo intestino oltre al colesterolo alimentare, che non dovrebbe superare i 300 mg al giorno, si ritrova anche quello trasportato dalla bile, circa 1 g. Sia il colesterolo alimentare che quello biliare sono per la maggior parte in forma non esterificata, circa l’85-90%, l’unica forma che sarà assorbita. Al pari delle vitamine, anche il colesterolo non rappresenta una fonte di energia.
Nel gruppo degli steroidi assunti con la dieta si possono annoverare anche vari steroli e stanoli vegetali, in particolare il beta-sitosterolo, che però in condizioni fisiologiche non è assorbito.
Nonostante le raccomandazioni di tutte le società scientifiche, che suggeriscono un apporto lipidico, e quindi fondamentalmente di trigliceridi, tale da coprire circa il 30% del fabbisogno energetico, a oggi nella dieta occidentale i lipidi arrivano a coprire dal 30 al 45% delle calorie giornaliere.
L’idrofobicità, una delle proprietà distintive di molti lipidi presenti nella dieta, che ad esempio rende i trigliceridi ottime molecole da utilizzare come depositi di energia, crea problemi nel momento in cui tali molecole devono essere digerite a livello intestinale, assorbite nel piccolo intestino, e trasportate in circolo dopo il loro assorbimento o mobilizzazione dai depositi corporei. E infatti, lipidi quali i trigliceridi con acidi grassi a catena lunga e gli esteri del colesterolo e delle vitamine liposolubili sono estremamente idrofobici, e nello stomaco e nell’intestino si aggregano a formare goccioline che dovranno essere emulsionate al fine di permettere alle specifiche idrolasi di catalizzare la digestione delle molecole in esse contenute.
Indice
Fasi, enzimi e prodotti
La digestione dei lipidi ha inizio nella bocca, prosegue nello stomaco e termina nel piccolo intestino o intestino tenue.
Gli enzimi che catalizzano le reazioni responsabili della digestione dei trigliceridi sono detti lipasi (EC 3.1.1.3).
Sono proteine che catalizzano la parziale idrolisi dei trigliceridi a dare una miscela di acidi grassi liberi e acilgliceroli. Esistono diverse lipasi, la più importante delle quali è prodotta dal pancreas esocrino. Le altre sono la lipasi linguale, la gastrica e quella presente nel latte materno.
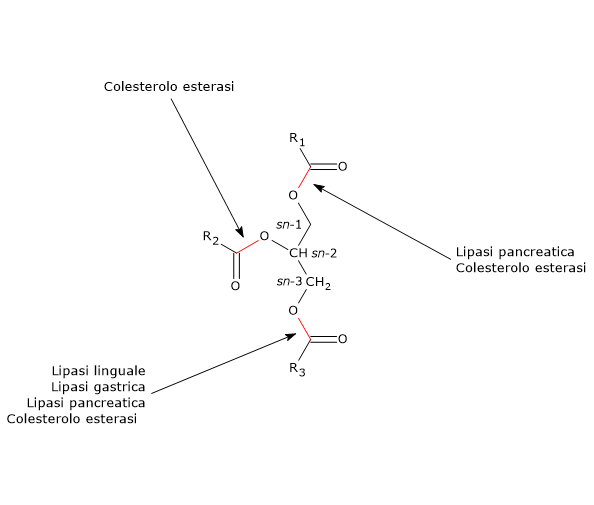
Altri enzimi coinvolti nella digestione dei lipidi sono la colesterolo esterasi e le fosfolipasi A1 e A2.
Digestione dei lipidi e lipasi linguale
Nella bocca grazie alla masticazione, il cibo è ridotto in piccole particelle e mescolato alla lipasi linguale.
L’enzima è prodotto e secreto dalle ghiandole sierose linguali o di von Ebner.
E’stabile in ambiente acido e quindi rimane attivo nello stomaco, e nel caso in cui manchi la secrezione di ione bicarbonato dal pancreas, anche nel piccolo intestino.
La reazione catalizzata dalla lipasi linguale porta alla liberazione di un singolo acido grasso, di preferenza a catena corta, come l’acido butirrico, o media, quali l’acido caproico, l’acido caprilico, l’acido caprico e l’acido laurico, e di un 1,2-diacilglicerolo la cui digestione terminerà nel duodeno
Nota: gli acidi grassi a catena corta sono in genere esterificati in posizione sn-3 del triacilglicerolo.
La lipasi linguale è responsabile di una modesta degradazione dei trigliceridi in quanto:
- ha un’azione più lenta della lipasi pancreatica;
- è attiva nello stomaco, un ambiente acquoso dove i lipidi tendono a coalescere, formando una fase separata dall’ambiente circostante, limitando così le opportunità per l’attacco ai trigliceridi.
Negli adulti sani l’azione dell’enzima è poco importante ai fini digestivi. Al contrario nei neonati, dove la lipasi pancreatica non è ancora pienamente attiva, la lipasi linguale è molto importante, avvantaggiata anche dal fatto che i trigliceridi del latte sono ricchi in acidi grassi a catena corta e media. Inoltre, al pari della lipasi gastrica è in grado di penetrare nei globuli di grasso del latte iniziando il processo digestivo, cosa che non può fare la lipasi pancreatica.
L’azione di questo enzima è ovviamente importante anche nei casi in cui sia assente la lipasi pancreatica.
Poiché la lingua non è sensibile al sapore dei trigliceridi ma a quello degli acidi grassi liberi, specialmente polinsaturi, l’azione della lipasi linguale potrebbe avere un ruolo anche nel rilevare i cibi grassi come fonte di energia, e dunque potrebbe influenzare le scelte alimentari.
Infine, il rilascio di acidi grassi a catena corta e media e di diacilgliceroli è importante anche perché sono molecole anfipatiche, ossia nella loro struttura si può individuare una regione idrofilica, che interagisce con l’ambiente acquoso circostante, e una idrofobica che potrà immergersi nell’ambiente apolare presente all’interno delle gocce lipidiche. Grazie all’azione di questi surfattanti le goccioline di grasso acquistano una superficie idrofila e quindi un’interfaccia stabile con l’ambiente acquoso. Questo, assieme all’opera di rimescolamento dello stomaco, porta alla formazione di un’emulsione composta da goccioline via via più piccole, che verrà poi riversata nel duodeno come chimo. Altre molecole anfipatiche presenti nella dieta sono la lecitina e i fosfolipidi. Complessivamente la loro azione permette di aumentare la superficie disponibile per l’attacco delle idrolasi coinvolte nella digestione dei lipidi.
Nello stomaco i lipidi sono mescolati anche con i succhi gastrici e l’acido cloridrico. L’acido cloridrico denatura le proteine dei complessi lipide-proteina, che di seguito sono attaccate dalle proteasi del succo gastrico. La risultante di questa azione è il rilascio dei lipidi legati.
Digestione dei lipidi e lipasi gastrica
Nello stomaco i lipidi incontrano una seconda lipasi acida, la lipasi gastrica, che viene secreta dalle cellule principali delle ghiandole del fondo dello stomaco.
L’enzima ha un pH ottimale intorno a 4, ma è comunque abbastanza attivo anche a valori di pH meno acidi, pari a 6-6,5. E’ quindi probabile che rimanga attivo anche nella parte alta del duodeno, dove il pH è compreso tra 6 e 7.
Catalizza di preferenza l’idrolisi dei trigliceridi con acidi grassi a catena corta e acidi grassi a catena media, ma può agire anche su quelli con acidi grassi a catena lunga. A prescindere dal tipo di acido grasso, catalizza di preferenza il distacco di quelli in posizione sn-3, portando alla liberazione di un acido grasso libero e un 1,2-diacilglicerolo, molecole come visto in grado di agire come surfattanti.
Al pari della lipasi linguale, è particolarmente attiva sui trigliceridi del latte anche materno, ricco di acidi grassi a catena corta e media, ma anche su quelli di alcuni oli tropicali ricchi di acidi grassi a catena media, come quello di cocco.
L’enzima può idrolizzare il 10-30% dei trigliceridi ingeriti, e nel neonato sino al 50% dei trigliceridi del latte materno.
Sali biliari ed emulsione delle gocce lipidiche
Il chimo, contenente un’emulsione lipidica in forma di goccioline di diametro inferiore a 0,5 mm, passa nella prima parte del piccolo intestino, il duodeno, dove la digestione dei lipidi prosegue.
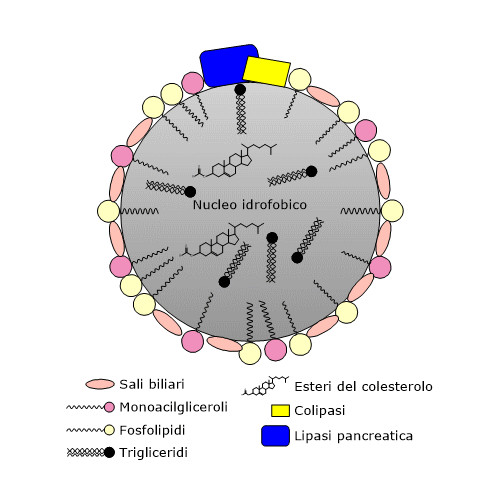
Nel duodeno si mescola alla bile, il cui rilascio dalla colecisti è stimolato dalla colecistochinina, secreta da cellule presenti nella mucosa del duodeno e del digiuno a seguito di un pasto, in particolare se ricco di grassi.
Nella bile, tra gli altri, sono contenuti sali biliari, fosfolipidi, e colesterolo. I sali biliari sono acidi biliari coniugati con glicina o taurina. A loro volta gli acidi biliari sono derivati ossigenati del colesterolo, anch’essi come i precedenti sali prodotti nel fegato. Sono molecole anfipatiche nel cui anello planare è possibile individuare una faccia idrofobica e una idrofilica; sono pertanto in grado emulsionare ulteriormente i lipidi ingeriti, aumentando l’accessibilità per le specifiche idrolasi.
In particolare, i sali dell’acido colico, contenendo tre gruppi ossidrilici, sono emulsionanti migliori rispetto ai sali dell’acido desossicolico, che invece ne contengono due.
Nota: giornalmente la colecisti secerne nel duodeno circa 30 g di sali biliari, assieme a fosfolipidi e colesterolo. La maggior parte dei sali biliari e del colesterolo è poi riassorbita, tanto che la loro perdita giornaliera con le feci è minima, 0,2-1 g.
Assieme al meccanismo fisico della peristalsi, i tensioattivi visti sinora, ossia acidi grassi liberi, acilgliceroli, fosfolipidi e sali biliari, assicurano la formazione di micelle microscopiche che aumentano ulteriormente le superfici disponibili per l’attacco degli enzimi idrolitici.
I trigliceridi contenenti acidi grassi a catena corta e media possono essere sia idrolizzati che assorbiti in assenza dei sali biliari, anche se la loro presenza ne aumenta l’assorbimento.
Digestione dei lipidi e lipasi pancreatica
La colecistochinina stimola anche il pancreas esocrino a secernere un succo pancreatico contenente, tra gli altri, la lipasi pancreatica.
L’enzima opera la digestione della maggior parte dei trigliceridi ingeriti, principalmente nella porzione superiore del digiuno
La lipasi pancreatica ha un pH ottimale di azione compreso tra 7,0 e 8,8, dunque non è una lipasi acida come le precedenti.
Catalizza di preferenza il distacco degli acidi grassi, in genere con 10 o più atomi di carbonio, in posizione sn-1 e sn-3 dello scheletro di glicerolo. I prodotti della reazione sono acidi grassi liberi e 2-monoacilgliceroli.
Il 2-monoacilglicerolo, la forma principale in cui i monoacilgliceroli sono assorbiti a livello del piccolo intestino, può subire un processo di isomerizzazione nel quale l’acido grasso rimanente si sposta sul carbonio 1 o 3, che però è più lento della velocità con cui la molecola viene assorbita.
La lipasi pancreatica per la sua attività non richiede la presenza dei sali biliari, dai quali anzi è inibita in vitro. Tuttavia in vivo, quindi in loro presenza, idrolizza in modo molto efficiente i trigliceridi. Ciò avviene grazie a una proteina del succo pancreatico, la colipasi. La molecola, priva di attività catalitica, è prodotta in forma inattiva, detta coprolipasi, ed è attivata nell’intestino per azione della tripsina. Le goccioline lipidiche sono rivestite di sali biliari e fosfolipidi che conferiscono alle stesse carica negativa, che previene il legame della lipasi ma attrae la colipasi. La colipasi a sua volta lega la lipasi pancreatica (lipasi e colipasi si legano in un rapporto molare di 1:1), permettendo così l’ancoraggio dell’enzima all’interfaccia acqua-lipide delle goccioline.
Lipasi del latte materno
Questa lipasi ha un pH ottimale di azione neutro ed è stimolata dai sali biliari. L’enzima contribuisce in modo sostanziale all’idrolisi dei trigliceridi nell’intestino dei bambini allattati al seno.
Non ci sono invece lipasi nel latte vaccino.
Digestione dei lipidi e colesterolo esterasi
Nel succo pancreatico è presente anche la colesterolo esterasi (EC 3.1.1.13), prodotta e secreta dal pancreas esocrino in forma attiva. Tra gli enzimi coinvolti nella digestione dei lipidi è quello con la più ampia specificità, essendo attivo su:
- esteri del colesterolo, con prodotti di reazione: colesterolo e acidi grassi liberi;
- trigliceridi, sui quali può idrolizzare tutti i legami estere, e per questo è anche detto esterasi non specifica, ed è attiva sul 10-15% dei trigliceridi ingeriti;
- monoacilgliceroli;
- fosfolipidi;
- esteri delle vitamina A e D.
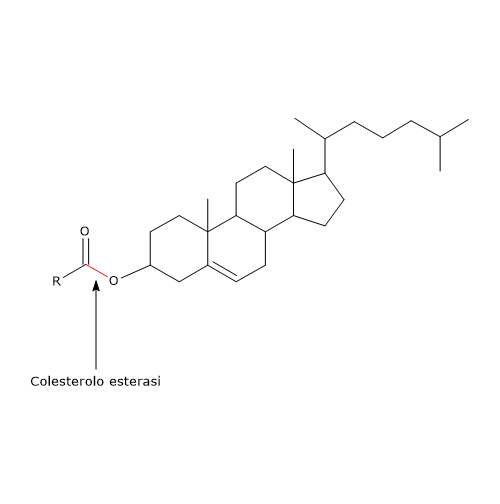
Al pari della fosfolipasi A2, è attiva di preferenza sugli esteri del colesterolo inglobati nelle micelle di sali biliari. Inoltre la sua attività è stimolata, a differenza della lipasi pancreatica, dai sali biliari, in particolare i sali triidrossilici, come il sodio taurocolato e glicocolato, che inducono una modificazione conformazionale in conseguenza della quale la proteina risulta attivata. La colesterolo esterasi è anche in grado di autoaggregarsi in strutture polimeriche, proprietà promossa dai sali triidrossilati visti in precedenza. La formazione di strutture polimeriche protegge l’enzima dall’azione delle proteasi attive nel lume intestinale.
Digestione dei lipidi e fosfolipasi
La digestione dei fosfolipidi avviene in reazioni catalizzate da fosfolipasi, per la maggior parte la fosfolipasi A2 pancreatica (EC 3.1.1.4). L’enzima è presente nel succo pancreatico in forma di zimogeno, detto profosfolipasi A2, e attivato nel lume intestinale dall’azione della tripsina, enzima che interviene nella digestione delle proteine.
La fosfolipasi A2 catalizza in modo specifico il distacco dell’acido grasso in posizione sn-2 del fosfolipide, mentre ha una specificità molto ampia sia per quanto riguarda la lunghezza della catena carboniosa dell’acido grasso bersaglio che del gruppo presente nella testa polare del fosfolipide.
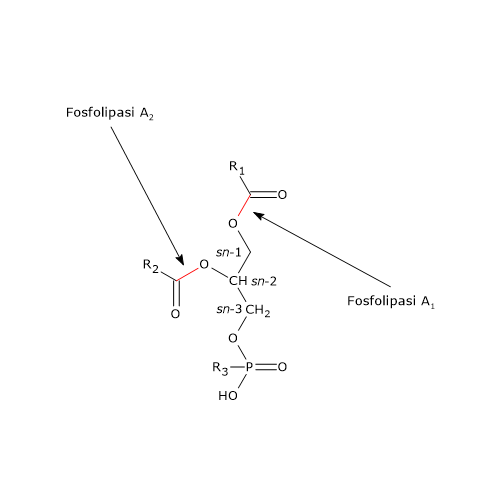
La maggior parte dei fosfolipidi idrolizzati sono di origine biliare mentre una minima parte deriva dai cibi.
Nella bile i fosfolipidi sono presenti in micelle miste con il colesterolo e i sali biliari, e nel lume intestinale si distribuiranno tra le goccioline lipidiche e le micelle miste, con una preferenza per queste ultime. Ed è nelle micelle miste che il fosfolipide, per la maggior parte fosfatidilcolina, funge da substrato. Nel caso della fosfatidilcolina i prodotti della reazione sono un acido grasso libero e lisofosfatidilcolina, un lisofosfolipide.
Nel succo pancreatico è presente anche una fosfolipasi A1, che rimuove l’acido grasso dalla posizione sn-1 del fosfolipide.
Nella mucosa intestinale sembra essere presente una terza, modesta, attività fosfolipasica, grazie a un enzima intrinseco di membrana dell’enterocita, chiamato fosfolipasi B o retinil estere idrolasi, essendo attivo anche sugli esteri della vitamina A.
La digestione dei fosfolipidi può fermarsi ai lisofosfolipidi o essere completa.
Bibliografia
- Bender D.A. Introduction to nutrition and metabolism. 3rd Edition. Taylor & Francis, 2004
- Berdanier C.D., Dwyer J., Feldman E.B. Handbook of nutrition and food. 2th Edition. CRC Press. Taylor & Francis Group, 2007
- Chow Ching K. “Fatty acids in foods and their health implication” 3th Edition. CRC Press Taylor & Francis Group, 2008
- Hamosh M. Lingual and gastric lipases. Nutrition 1990;6(6):421-8.
- Iqbal J. and Hussain M.M. Intestinal lipid absorption. Am J Physiol Endocrinol Metab 2009;296:E1183-1194. doi:10.1152/ajpendo.90899.2008
- Nelson D.L., Cox M.M. Lehninger. Principles of biochemistry. 6th Edition. W.H. Freeman and Company, 2012
- Rosenthal M.D., Glew R.H. Medical Biochemistry – Human Metabolism in Health and Disease. John Wiley J. & Sons, Inc., Publication, 2009
- Stipanuk M.H., Caudill M.A. Biochemical, physiological, and molecular aspects of human nutrition. 3rd Edition. Elsevier health sciences, 2012